Спасет ли генная терапия от рака?

В конце 2015-го годовалая девочка Лейла из Великобритании умирала от острого лимфобластного лейкоза — одного из видов рака крови. Традиционные методы лечения — химиотерапия и пересадка костного мозга — не помогли. Врач малышки, Пол Вейс, констатировал: в такой стадии болезнь уже неизлечима. Но родители Лейлы не захотели сдаваться.
Они убедили докторов написать профессору Университетского колледжа Лондона Васиму Касиму, который разрабатывал новый метод генетической терапии рака и согласился попробовать с его помощью вылечить Лейлу.
Касим намеревался «отредактировать» защитные клетки организма так, чтобы они смогли сами уничтожить злокачественные новообразования, без помощи лекарств.
Зачем нужна генная терапия рака?
В 2015 году на онкологические заболевания пришлось 15% всех смертей в мире. По прогнозу ВОЗ, к 2030 году их доля вырастет до 18%. Чтобы снизить смертность от рака, нужны эффективные способы ранней диагностики и более продвинутые методы лечения.
Подходы к лечению рака, которые используют сегодня, эффективны на ранней стадии заболевания. Если болезнь выявляют рано, химиотерапия и лучевая терапия помогают вылечить до 95% пациентов. Но при нынешней системе здравоохранения в России как минимум 20% больных раком обращаются за помощью на поздней стадии, когда вероятность выжить — не больше 25-30%.
Для того, чтобы выявлять рак на ранней стадии у всех больных, нужно проводить регулярные скрининги населения на все виды онкологии. Такого нет нигде в мире — это крайне дорого и, в большинстве случаев, бессмысленно. «Онкомаркеры [специфические вещества, которые обнаруживаются в крови и/или моче больных раком — прим. ред.
] совершенно ни о чем не говорят: они могут быть повышены у здорового человека и быть в норме у больного. Имеет смысл использовать онкомаркеры только для наблюдения за динамикой пациента, который уже проходит лечение. От маммографии, которую назначают всем женщинам после 35 для мониторинга рака груди, иногда вреда больше, чем пользы.
Флюорография обнаружит рак легких только на поздней стадии, когда сделать уже почти ничего нельзя.
А при полной МРТ всего тела почти у каждого человека можно найти «что-то, похожее на рак», что повлечет за собой еще ряд дорогостоящих, зачастую болезненных и совершенно ненужных обследований», — говорит исполнительный директор Фонда профилактики рака Илья Фоминцев.
Второй вариант — разработать методы лечения, которые будут эффективны даже на поздних стадиях развития болезни. Наиболее популярное сегодня средство —химиотерапия — в запущенных случаях работает плохо.
К примеру, при лечении последней, четвертой стадии рака желудка выживаемость в течение пяти лет составляет 15-20% (то есть через пять лет умрут от 75 до 80% больных, прошедших терапию), рака яичников — не более 5%.
И для того, чтобы получить этот шанс на излечение, нужно пройти много курсов химиотерапии, которая истощает организм: используемые препараты вместе со злокачественными убивают и здоровые клетки.
К тому же, во многих случаях вырабатывается резистентность — клетки опухоли адаптируются и больше не реагируют на вещества, используемые для химиотерапии.
Детям, которые, как Лейла, заболели лейкозом, традиционные методы лечения помогут выздороветь в 90% случаев. У менее удачливых 10% случается рецидив — после него часто развивается резистентность к «химии», шансы выжить уже не более 30%. Этих и многих других людей, на которых не действуют привычные методы, может спасти генная терапия.
Генетически модифицированный иммунитет
Ученые придумали несколько вариантов того, как можно отредактировать гены, чтобы избавить человека от рака.
Один из них, довольно простой и поэтому популярный: взять у пациента Т-лимфоциты — его собственные защитные клетки — и ввести в них ген рецептора, который распознает клетки опухоли.
Рак распространяется в организме потому, что защитные силы человека не распознают делящиеся клетки как чужеродные и вовремя не уничтожают их. Почему происходят такие сбои в защитной системе до конца неизвестно — механизм работы иммунитета слишком сложен.
Вместо того, чтобы пытаться починить всю систему в целом, ученые придумывают способы обучить Т-лимфоциты целенаправленно «узнавать» клетки опухоли и бороться с ними.
Вирусы против рака
При помощи генной терапии в Детской больнице Филадельфии уже вылечили американку Эмили Уайтхед и еще несколько десятков детей.
В 2010 году пятилетней Эмили поставили тот же диагноз, что и маленькой Лейле — острый лимфобластный лейкоз.
Девочка попала в те самые несчастливые 10% — спустя 16 месяцев терапии у нее случился рецидив, и на традиционные способы лечения организм больше не реагировал.
Тогда врачи Эмили включили ее в экспериментальную программу по редактированию Т-лимфоцитов. Доктора собрали ее клетки и ввели в них ген рецептора к белку CD19, который расположен на поверхности злокачественных клеток у больных лейкозом.
Необходимую генетическую информацию доставили в Т-клетки при помощи обезвреженных ретровирусов — это вирусы, к которым относится, например, ВИЧ, умеют встраивать свою ДНК в гены человека.
Затем отредактированные Т-лимфоциты, которые «научились» распознавать и убивать мутировавшие клетки, ввели обратно в организм Эмили.
Через несколько недель после этой процедуры врачи обследовали девочку и объявили, что она здорова. Эмили скоро исполнится 12 лет, с 2012 года в ее организме больше не обнаруживали следов рака.
После успешного излечения первого пациента врачи больницы Филадельфии применили эту терапию, которую назвали CTL019, еще к сотне больных детей, которые не отвечали на другие виды лечения. Эффективность составила 90%.
Метод CTL019 используют не только в Детской больнице Филадельфии. Сегодня в Университете Пенсильвании проводятся полноценные клинические испытания этой терапии против лимфобластного лейкоза, а также других видов рака крови — лимфомы и лейкемии — в том числе у взрослых.
Финансирует исследования крупная фармацевтическая компания Novartis. В этих исследованиях эффективность терапии составляет примерно 50%.
Если Novartis получит одобрение Управления по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA, американский аналог Роспотребнадзора), препарат на основе CTL019 может появиться на рынке уже в 2017 году.
Генетические «ножницы»
Технология, которую применил Васим Касим для лечения годовалой Лейлы, сложнее. Теоретически, Лейле могла бы помочь терапия CTL019, если бы не одно «но»: в организме девочки почти не осталось здоровых Т-клеток — она была слишком мала и слишком больна. Тогда Касим решил пересадить Лейле Т-лимфоциты от донора.
Лечение онкологических больных при помощи донорских Т-клеток, с одной стороны, имеет хорошие перспективы. Клетки от одного донора можно модифицировать и пересадить сотням пациентов — это гораздо дешевле, чем редактировать клетки каждого больного.
С другой стороны, в организме пациента донорские Т-лимфоциты могут воспринять все, в том числе здоровые клетки, как чужеродные — и начать уничтожать их.
Более того, собственные Т-клетки пациента, если они еще не до конца ослаблены болезнью и лекарствами, могут принять донорские клетки за «врага» и уничтожить их.
Чтобы этого не произошло, Касим предварительно отредактировал Т-клетки донора.
Он вырезал ген, который отвечает за распознавание клеток пациента как чужеродных, и добавил ген рецептора, который воспринимает белок CD19 на поверхности опухолевых клеток.
Таким образом, после модификации Т-клетки донора должны были атаковать только злокачественные клетки. Потом он вырезал еще ген у донорских клеток, сделав их «невидимыми» для иммунитета Лейлы.
5 ноября 2015 года на пресс-конференции в Лондоне лечащие врачи Лейлы объявили, что она здорова. Окончательные результаты можно будет оценить лишь через пару лет после завершения терапии, но на данный момент в организме девочки не осталось следов рака.
Надежда на CRISPR/Cas9
Метод Васима Касима отличается от более ранних видов генной терапии тем, что позволяет не только добавить нужные гены, но и вырезать «вредные». Более того, подобные генетические «ножницы» в теории дают возможность отредактировать любые клетки организма. Многие ученые считают, что такой подход наиболее перспективен для генной терапии рака.
«Добавить какой-то ген в отдельные клетки, например, Т-лимфоциты, в пробирке не трудно. Гораздо сложнее отредактировать все клетки во всем организме, вырезать из них все «вредные» гены или, наоборот, добавить полезные.
Пока мы не научились этого делать, но, если ученым удастся найти способ, мы сможем не только лечить рак, но и избавлять людей от тяжелых генетических заболеваний», — говорит руководитель отделения онкодиагностики биомедицинского холдинга «Атлас» Владислав Милейко.
21 июня 2016 года этическая комиссия США одобрила первое исследование по редактированию ДНК человека при помощи перспективной генетической технологии CRISPR/Cas9 — технологию будут использовать для борьбы с раком. CRISPR/Cas9 — это комплекс ферментов, которые работают как генетические «ножницы». В основе их работы лежит механизм, похожий на поиск преступника по фотороботу.
Ученые встраивают в один из компонентов системы последовательность ДНК, которую нужно найти и распознать. Когда «враг» обнаружен, в работу включается белок-«ножницы» Cas9, который вырезает соответствующий ген.
Специалисты по генной терапии рака предположили, что с помощью CRISPR/Cas9 можно прямо внутри организма вырезать гены злокачественных клеток, работа которых мешает иммунитету бороться с болезнью.
В клинических исследованиях ученые Пенсильванского университета при помощи технологии CRISPR «отключают» в иммунных клетках ген, кодирующий белок PD-1 — он обезвреживает Т-лимфоциты и не дает им бороться с опухолями. В опытах на мышах отредактированные при помощи CRISPR/Cas9 Т-клетки гораздо лучше справлялись с опухолью в легких, чем обычные Т-клетки.
«Наши предварительные данные показывают, что технология CRISPR/Cas9 сделает Т-лимфоциты гораздо более эффективными в борьбе с раком», — говорит специалист по генной терапии рака из Пенсильванского университета Карл Джун. В ближайшие два года в клинических испытаниях Джун и его команда планируют с помощью CRISPR/Cas9 лечить людей с множественной миеломой, меланомой и саркомой.
Исследователи во всем мире в ближайшее время ждут всплеска новых работ по внедрению CRISPR/Cas9 (в частности, для лечения рака) в США. Дело в том, что недавно американские власти наконец выдали патент на эту технологию.
А вот предприимчивые китайцы уже запустили первую программу редактирования генома в октябре 2016 года. Технологию CRISPR/Cas9 китайские ученые использовали в клинических испытаниях новой терапии рака легких. Научное сообщество с нетерпением ждет результатов, а онкологи из Китая уже планируют аналогичные испытания для лечения рака простаты, мочевого пузыря и карциномы почек.
Появится ли волшебная генетическая «таблетка» от рака?
У методов генной терапии, которые используют в лечении раковых больных сегодня, есть существенные ограничения.
В основном с их помощью редактируют Т-лимфоциты, причем очень специфическим образом: обучая их распознавать единственный белок и бороться с определенным видом опухолевых клеток.
Такой подход эффективно работает при заболеваниях крови. С лечением других видов рака генными методами все сложнее.
«В случае с лейкемией и другими видами злокачественных заболеваний крови отредактированные Т-лимфоциты попадают прямо в кровоток, где они тут же начинают уничтожать раковые клетки.
Если говорить о других опухолях, нужно еще придумать, как доставить модифицированные Т-лимфоциты к нужному органу в достаточном количестве, особенно если этот орган не слишком хорошо снабжается кровью», — объясняет Владислав Милейко.
Помимо проблем с доставкой Т-лимфоцитов к выбранному органу, перед учеными встает вопрос поиска нужных антигенов — белков на поверхности злокачественных клеток, которые помогают иммунитету распознать их как чужеродные и уничтожить.
Заболевания крови в этом смысле более простые — все раковые клетки несут на поверхности один и тот же белок-антиген.
Другие злокачественные образования, в частности, опухоли, имеют более сложное строение и могут нести много разных антигенов.
Директор отделения хирургической онкологии клиники Мерси в Балтиморе, США Вадим Гущин объясняет суть проблемы: если модифицировать Т-клетки на борьбу лишь с одним антигеном, они убьют только часть раковых клеток, а остальные продолжат расти. Сегодня исследователи ищут технологию, которая позволит прямо в организме распознавать антигены, необходимые для борьбы с опухолью, и получать такие Т-лимфоциты, у которых будут рецепторы к этим антигенам.
«Будет ли этой технологией CRISPR/Cas9 или какая-то другая методика — пока непонятно. Разработок в этой сфере ведется очень много. Из всех проектов моих коллег, которые занимаются исследованиями в этой области, 9 из 10 закончились ничем. Но это нормальный научный процесс — надеюсь, рано или поздно одна из технологий выстрелит», — говорит Вадим Гущин.
Кроме того, пока генная терапия рака — это очень дорого: курс лечения, по оценкам экспертов Citigroup, стоит около 500 тысяч долларов, что в 10-20 раз превышает стоимость традиционной терапии. Но эксперты уверены, что рано или поздно этот вид терапии станет куда более доступным.
«Первая расшифровка генома человека в 2000 году стоила 3 млрд долларов, сейчас она обойдется в несколько тысяч. Точно так же генные методы терапии в недалеком будущем станут гораздо дешевле», — предрекает Вадим Гущин.
С ним согласен и Владислав Милейко: «Раньше ученые больше размышляли о генной терапии в контексте лечения редких генетических мутаций. А проблема редких заболеваний именно в том, что они редкие — лекарства от них априори будут стоить очень дорого. Разработки генной терапии против рака интересны миллионам.
Если ученым удастся найти эффективную технологию лечения, рано или поздно за счет своей массовости она станет доступной».
Похожее
Источник: https://techfusion.ru/gene-therapy-vs-cancer/
Генная терапия против рака: последние разработки
Израильские учёные в преддверии сенсационных открытий в вопросе лечения всех видов рака. Метод модифицированных лимфоцитов уже избавил многих больных, страдающих заболеванием рака крови. Следующая ступень развития – все солидные злокачественные образования.
Обучить иммунную систему самостоятельно уничтожать раковые клетки
Известно, чтобы в поединке с раковыми новообразованиями одержать победу, необходимо добиться трансформации самой иммунной системы человека. Раковые клетки практически не распознаются ею, так как являются собственными клетками организма. И единственный способ добиться успеха в борьбе со злокачественной опухолью – обучить этой борьбе саму иммунную систему.
Лейкоциты-убийцы
Так как успех исцеления напрямую зависит от изменений в иммунной системе, исследователи задействовали клетки, защищающие организм от вирусных и иного рода атак.
Из образцов крови выделяются лейкоциты, они видоизменяются с помощью нового гена. Можно сказать, он и обучает в дальнейшем способности узнавать мутировавшие клетки. После чего преобразованные клетки размножаются лабораторным путём и вновь помещаются в организм больного. Таким образом, укрепляется иммунная система.
Вновь образовавшиеся клетки вырабатывают антитела и начинают атаку на клетки опухоли, определяя их, как инфекции.
Найдено универсальное лекарство?
Однако не следует считать, что антиген CAR-T является универсальным для всех видов рака. Лекарство служит для лечения лимфомы и лейкемии. Но та же концепция лежит в основе борьбы с другими злокачественными опухолями.
На данный момент задача исследователей состоит в следующем: закрепить свою уверенность в том, что модифицированные лейкоциты не повреждают здоровые клетки. По словам учёных на это уйдёт лишь несколько лет.
Как были открыты CAR-T?
Базой в лечении CAR-T является опыт исследований, проводимых на протяжении 20 лет. Клинические испытания технологии ещё не закончены, но в тех случаях, когда она применялась, отмечены превосходные результаты. Это лечение не только не разрушает иммунную систему человека, но и оставляет её неповреждённой. При этом оно характеризуется минимальным набором побочных эффектов.
Где ещё будет применима терапия?
Учёными проводится огромное количество испытаний, в ходе которых тестируются ТАР Т-клетки. Всё их внимание направлено на повышение эффективности технологий лечения, в которых задействована иммунная система человека, возможности применения их в лечении всех видов онкологических заболеваний.
Насколько эффективна технология?
Рассматриваемая технология показывает достаточно обнадёживающие результаты. В течение нескольких лет окончательно станет ясно, придёт ли она на смену трансплантации костного мозга, станет ли возможным упрощение процедуры получения терапевтических клеток, её удешевление, будет ли она широко применяемой в лечении онкологических больных.
Источник: https://HospitalAssuta.ru/news/gennaya-terapiya-stanet-osnovoj-v-borbe-s-rakovymi-opuholyami.html
5 супертехнологий лечения рака, доступных уже сегодня

Найти единственную «чудо-таблетку от рака», к сожалению, вряд ли получится. Это слишком сложное и комплексное заболевание: даже в одной опухоли может быть несколько разных мутаций — и для борьбы с каждой потребуется свое лекарство.
Но наука на месте не стоит, и специалисты постоянно разрабатывают новые методы борьбы с разными опухолями. Расскажем о самых перспективных технологиях лечения.
Генная терапия
Почему в целом развивается рак? В обычных, здоровых клетках происходят мутации генов, которые заставляют их неконтролируемо делиться. Если рак возникает ввиду «поломки» в генах, может, другие гены помогут победить болезнь?
Генная терапия уже эффективно работает против лейкоза. Вот что придумали врачи из Детской больницы Филадельфии: собрать защитные клетки пациентов, Т-лимфоциты, и добавить в них новый ген для борьбы с болезнью.
На поверхности злокачественных клеток у пациентов с лейкемией есть особый белок — CD19. Обычные Т-лимфоциты его «не видят» — именно поэтому рак распространяется по организму.
Но специалисты придумали, как обучить иммунитет для борьбы с лейкемией. К Т-лимфоцитам пациентов они добавили ген рецептора белка CD19. Сделали это при помощи обезвреженных ретровирусов — подобные вирусы умеют встраивать свою ДНК в гены человека.
Когда генетически модифицированные клетки иммунитета вернули в организм больных, Т-лимфоциты стали атаковать злокачественные клетки. Результат оказался поразительным — 90% детей с тяжелой рецидивирующей лейкемией пошли на поправку.
Российские специалисты разрабатывают собственные лекарства для генной терапии. Скажем, препараты АнтионкоРАН-М и АнтионкоРАН-F, содержат по два гена: один убивает злокачественные клетки, а другой стимулирует иммунитет. Пока что препараты исследовали только на животных, но они уже показали эффективность против опухолей головы и шеи, прямой кишки, шейки матки, молочной железы.
Генетические «ножницы»
Еще один новый способ терапии, связанный с генами, — это так называемые генетические «ножницы», или технология редактирования генома CRISPR/Cas9. В отличие от генной терапии, комплекс CRISPR/Cas9 не добавляет новые гены, а вырезает вредные.
Технологию CRISPR/Cas9 в действительности придумали не люди, а бактерии. Благодаря ей они обучают свой иммунитет и борются с опасными вирусами.
В ДНК бактерии закодирована генетическая информация обо всех вирусах, которые встречала она и ее предки. Эта информация «зашита» в ДНК между короткими повторами, своеобразными разделителями, которые специалисты назвали CRISPR. Если бактерия видит вирус, чьи гены записаны в ее ДНК, она уничтожает его при помощи специального белка Cas9.
И как иммунная система бактерий поможет человеку бороться с раком?
Научные специалисты придумали, как использовать комплекс CRISPR/Cas9 в лечении человека. Они предложили точно так же, как у бактерий, записать между последовательностями CRISPR данные о «вредных» генах, а потом удалить их с помощью Cas9.
Китайские исследователи уже изучают эффективность CRISPR/Cas9 в борьбе с раком легкого. Подобные эксперименты они планируют провести для лечения рака простаты и рака мочевого пузыря. А американские специалисты собираются тестировать CRISPR/Cas9 в терапии больных лейкемией, саркомой и меланомой.
Протонная терапия и «кибернож»
Прогрессивные разработки в области лучевой терапии уже плотно вошни в практику.
Классическая лучевая терапия, или радиотерапия, разрушает клетки опухоли при помощи радиоактивного излучения. Но есть у нее и минусы — радиация может повреждать и здоровые клетки вокруг опухоли.
Протонная терапия позволяет максимально точно воздействовать на опухоль и при этом не повреждать здоровые ткани.
Протоны — это крупные частицы с относительно большой массой. Благодаря своей массе они не рассеиваются в тканях, а доходят до самой опухоли. Активные частицы разгоняют в специальном устройстве, которое называется протонным ускорителем. Затем пучок излучения направляют точно на опухоль, протоны атакуют раковые клетки и разрушают их.
Протонная терапия может быть эффективна при таких видах рака, которые с трудом поддаются традиционному лечению — например, при неоперабельных опухолях головного мозга.
Как рассказал генеральный директор ФГБУ «НМИРЦ», академик РАН Андрей Каприн, в институте сейчас идут клинические исследования протонной терапии в лечении лимфомы, рака мочевого пузыря, рака шейки матки, рака пищевода, саркомы мягких тканей и рака поджелудочной железы.
Еще один метод высокоточной лучевой терапии — это так называемый кибернож. Эта технология позволяет удалить опухоль без боли и без разрезов, причем даже в труднодоступных местах.
Кибернож — это радиохирургический комплекс, который при помощи мощной компьютерной системы направляет пучок излучения с микроскопической точностью.
Благодаря этому опухоль уничтожается, а окружающие ткани остаются невредимы.
Чаще всего киберножом удаляют опухоли головного и спинного мозга, а также метастазы в разных органах.
Таргетная терапия
В отличие от химиотерапии, которая убивает все подряд, включая здоровые клетки, таргетная терапия действует на раковые клетки специфическим образом. Каким именно — зависит от типа и свойств самой опухоли.
На самом деле таргетная терапия не так уж и нова. Она возникла примерно полвека назад в лечении рака молочной железы. Научные специалисты обнаружили, что некоторые опухоли молочной железы зависят от женских половых гормонов — эстрогенов.
При воздействии эстрогенов на опухоль она начинает активнее расти и развиваться.
Тогда исследователи решили использовать антигормональный препарат тамоксифен: он присоединялся к эстрогеновым рецепторам, расположенным на поверхности опухоли, и вместо стимулирования роста уничтожал ее.
Такая терапия оказалась очень эффективной, и врачи решили продолжить исследования. Подобная гормональная таргетная терапия оказалась эффективной против рака предстательной железы.
Но таргетная терапия не ограничивается гормонами. Скажем, в 2016 году в России зарегистрировали препарат пембролизумаб — он подавляет белок PD-L1 на поверхности опухолей. Этот белок обманывает иммунную систему человека и не позволяет ей бороться с раком. Пембролизумаб «перезапускает» иммунную систему, давая ей шанс победить меланому на поздних стадиях и рак легкого.
Фотодинамическая терапия
Это малоинвазивный метод лечения поверхностного рака на ранних стадиях.
Суть такова: в организм вводят специальное вещество — фотосенсибилизатор. Это вещество можно вводить как внутривенно, так и местно в область опухоли. Затем на организм воздействуют особым световым излучением — оно активирует фотосенсибилизатор и заставляет его уничтожать раковые клетки.
Такая терапия наиболее часто используется для лечения рака кожи — этот метод эффективен и не оставляет шрамов, в отличие от хирургического вмешательства. Также фотодинамическую терапию можно применять при поверхностных опухолях на слизистой, к примеру, желудка или шейки матки.
«Сейчас мы проводим исследования и ищем такой фотосенсибилизатор, который поможет бороться с более глубокими опухолями. Мы уже разработали один препарат — в экспериментах на животных он показал 100% эффективность в лечении саркомы, карциномы предстательной железы и толстой кишки, легкого и печени. Теперь нам предстоят клинические исследования на людях», — говорит Андрей Каприн.
Источник: https://krasgmu.net/blog/5_supertekhnologij_lechenija_raka_dostupnykh_uzhe_segodnja/2017-06-28-5306
Генная терапия — «ноу-хау» в лечении рака и наследственных заболеваний
Исследования ученых подтверждают эффективность методики против рака, ВИЧ и наследственных заболеваний
Генная терапия — лечение болезней при помощи введения или наоборот удаления генов.
Впервые способ генотерапии наследственных заболеваний был успешно опробован в 1990 г. учеными из США. Пациенткой стала 4-летняя девочка. Ее организм не вырабатывал необходимый белок, что разрушало иммунную систему. После введения копии неработающего гена защитные функции организма ребенка восстановились.
Генотерапия и клетки-мишени
Генная терапия использует 3 основных подхода.
- Активация генов самого организма, чтобы «отключить» действия гена-мутанта.
- Фетальная генотерапия. Чужую ДНК вводят в эмбрион на ранней стадии развития. Внесенная информация передается и следующим поколениям.
- Соматическая генотерапия. Дополнительные гены вводят в соматические клетки, т. е в те, которые не принимают участия в половом размножении. «Отредактированный» вариант ДНК потомкам не передается, но технология улучшает состояние пациента.
80 млн человек с генетической атрофией зрительного нерва стали лучше видеть после генотерапии с модифицированным аденовирусом. Он внес «исправный» ген в клетки глаз.
Вирус против вируса
Существуют 2 метода генной терапии.
- Первый основан на том, что ученые помещают нужную информацию в кольцевую молекулу ДНК. Потом ее внедряют в клетку организма. Недостаток метода в том, что процедуру нужно повторять, т. к. клетки постоянно обновляются.
- Использование вирусов как носителей генной информации. Медицинские генетики убирают у вируса белки, которые отвечают за его способность вызывать болезнь. В его ДНК остается только информация, как проникать в клетку организма.
Преимущество вируса в том, что он сам находит нужную клетку в организме. Вирус гепатита внедряется в печень, а вирус герпеса — в нейроны. Но процесс невозможно контролировать, поэтому есть риск развития раковых заболеваний.
В свою очередь иммунная система человека стремится уничтожить вирус. В таком случае иммунитет «убивает» вирус до того, как он внедрился в клетку и «отремонтировал» поломку в генетическом коде. Другая опасность — организм может ответить чрезмерно сильной иммунной реакцией, которая ухудшит состояние пациента.
Генотерапия как панацея
Исследования доказывают эффективность генотерапии против таких групп заболеваний:
- наследственные (гемофилия, иммунодефициты, болезни накопления, недостаток ферментов)
- онкологические
- кардиологические
- неврологические заболевания
- инфекционные заболевания (в том числе вызванные ВИЧ).
Лекарство от ВИЧ
Эффективным приемом генной терапии стала адресная инактивация генов, т. е. их «отключение». Чтобы получить лечебный эффект, ученые используют рибозимы — соединения РНК и белка. Вещество способно расщеплять РНК вируса. Этот метод применяется в экспериментах при лечении ВИЧ-инфекций, гепатита B и онкологии.
Одно из самых перспективных открытий в области генотерапии — система CRISPR/Cas9. Ученые обнаружили бактерии, стойкие к вирусным инфекциям. Их ДНК включает особую последовательность генов (CRISPR). Они вырабатывают РНК, которая связывается с ДНК вируса и обозначает чужеродный фрагмент. Далее его «вырезает» белок Cas9.
Открытие показало, как отремонтировать или вырезать поврежденный ген. Вылечить клетку можно как от мутации, так и от атаки вируса. Ученые предполагают, что метод позволит победить ВИЧ.
Как редактируют эмбрионы
Ученые из Китая первыми «отредактировали» человеческие эмбрионы, полученные путем искусственного оплодотворения. Лечили зародышей от наследственного заболевания крови — талассемии.
В США также был проведен эксперимент с эмбрионами. Их избавляли от наследственной болезни сердца — гипертрофической кардиомиопатии. Эффективность лечения составила 25%.
Все эмбрионы после завершения эксперимента были уничтожены из этических соображений. Технология CRISPR/Cas9 еще не достаточно надежна: чужеродная ДНК может повредить геном хозяина. Но полученные во время экспериментов данные можно использовать для диагностики заболеваний до рождения.
Генотерапия рака
Раковые клетки появляются в результате генетических изменений. Если починить поломки в коде клеток — болезнь будет побеждена.
Методы генотерапии против онкологии
- Использование CRISPR/Cas9. Инструмент может починить часть гена, ответственную за самоуничтожение клеток. Таким образом они теряют способность к постоянному делению.
Пока исследования показали свою эффективность на отдельных извлеченных из организма клетках.
- Модификация лейкоцитов при помощи методов генной терапии. Клетки «учатся» распознавать и уничтожать рак. В США одобрен уже второй такой препарат против лейкемии.
- Уничтожение раковых клеток при помощи вирусов с измененными генами.
Вирусы, которые могут быть использованы для генной терапии рака
| Вирус кори | не вызывает защитного ответа в раковых клетках |
| Вирус герпеса | способен переносить длинные последовательности «встроенных» генов |
| Лентивирус (производный от ВИЧ) | может «встроить» гены в неделящиеся клетки |
| Ретровирус | встраивается в чужой геном и обеспечивает стабильность изменений |
Клиники и разработки
Над генными методами борьбы с онкологией работают ученые исследовательского института при клинике Хадасса (Израиль). Подробная информация о клинике — по ссылке bookimed.com/clinic/hadassah/
Подобные исследования проводят и специалисты клиники Самсунг (Южная Корея).
Над созданием безвредных и эффективных вирусов-носителей генетического материала работают ученые клиники Шарите (Германия). В экспериментах они используют рекомбинантные адено-ассоциированные вирусы. Методика пока на стадии лабораторных исследований. Но в будущем она поможет в лечении эпилепсии, болезни Паркинсона и Альцгеймера.
В США на развитие методов генной терапии потратят $ 190 млн в течение 6 лет.
Многие методы генной терапии еще на стадии лабораторных разработок и исследований. Но, по мнению специалистов, генная терапия может стать не только эффективным лекарством. Применять ее для клеток, участвующих в половом размножении — опасно. Искусственные гены могут засорить генофонд и человечество столкнется с непредсказуемыми мутациями.
Источник: https://fakty.ua/258404-gennaya-terapiya-nou-hau-v-lechenii-raka-i-nasledstvennyh-zabolevanij
Таргетированная терапия рака на основе генетического тестирования, как это происходит в Америке
Что такое «таргетированная терапия рака»? Это — индивидуально подобранное лечение на основании генетического анализа.
О там, какие подводные камни таит в себе «таргетированная терапия», читайте в статье Крейга Сейлора из американского журнала «Олимпиан»
Клиника Multicare в Гиг Харборе
Северо-запад тихого океана — эпицентр генетических исследований. Каждый день создаются новые препараты для лечения разных раковых мутаций.
Онкологи Гиг Харбора подарили новую жизнь троим пациентам в том числе бывшему президенту США — Джимми Картеру, благодаря новым достижениями в генетической диагностике рака, заставившим рак отступить.
Онкологи говорят, успех в понимании генетики рака побудил новую лавину научных исследований диагностики и лечения.
Рак уносит миллионы жизней в год. В течении многих десятилетий химиотерапия была основой лечения рака.
Теперь строительные блоки раковой опухоли — ее генный код – разобран на части и найдены места генетических поломок — мутаций. Это в свою очередь позволило создать лекарства для конкретных поломанных генов.
«Это то, к чему мы стремились — индивидуальный подход к каждому больному» — говорит доктор Эрик Холланд из онкологического исследовательского центра Фреда Хьютчинсона в Сиэтле.
«Можно взять одну опухоль и сравнить ее данные с банком данных других опухолей. Северо-запад тихого океана стал центром такого рода исследований.
Способность оперировать большими данными и их визуализация — это реальный прорыв! Это прорыв на уровне Майкрософта и Амазона, это понимают те, кто связан с «большими числами»…»
Марии Дугиль, матери троих детей, в 1997г было 30, когда она узнала о том, что больна раком груди. Ее младшей дочери был только год.
«Я была здорова, я не курила, не пила, я занималась спортом, и в моей семье НЕ БЫЛО РАКА»…
Пациентке срочно была выполнена мастэктомия и назначена химиотерапия с последующим облучением.
Как и многие тысячи несчастных людей она месяц за месяцем страдала от тошноты и других побочных эффектов лечения.
- Химиотерапия объединяет более сотни лекарств и методов, которые направлены на убийство раковых клеток. Онкологи используют их в разных комбинациях.
- Химиотерапия базируется на понимании того, из какого органа происходит опухоль. Иными словами, если был диагностирован рак груди, но он метастазировал в печень или мозг, то его лечат, как рак груди. В случае Джимми Картера меланома — опухоль кожи, которая дала метастазы в мозг, лечится как меланома.
- Не всех исцеляет химиотерапия, но она позволяет «законсервировать» опухоль и продлить жизнь даже в запущенных случаях, как это было с велосипедистом Лэнсом Армстронгом.
Химиотерапия — универсальная терапия, так сказать, «ван-сайз — один-размер-подходит-всем» «Большинство противораковых лекарств имеют широкое воздействие на организм.
Они убийственны для клеток», говорит доктор Джон Кич из онкологического центра Мультикеа в Гиг Харборе «Смысл химиотерапии в том, что придушенные раковые клетки не могут оправиться от воздействия, а нормальные частично могут.
» Тошнота и выпадение волос, поражение сердца, и даже провоцирование нового рака в отдаленном периоде после лечения — вот сторонние эффекты химиотерапии. В случае Марии химиотерапия сработала хорошо.
«В 2007 я решила на всякий случай провериться, я как раз перешагнула отметку в 10 летний срок жизни.»- говорит она.
«В 2010 меня стала беспокоить грыжа, но увы, это оказались метастазы в печень. Я только спросила врача: сколько мне осталось?»- «Два года»
Миссис Дугиль решила пройти генетическое тестирование.
Согласно с данными клиники Майо, одна из пяти пациенток с раком молочной железы имеет мутацию гена, который вызывает повышение в организме специфического белка.
Этот белок называется HER2 (человеческий эпидермальный фактор роста опухолей). Белок стимулирует рост раковых клеток.
С момента его открытия было изобретено лекарство — Герцептин, для таргетированной терапии мутировавшего гена HER2
У Дугиль этот белок не был повышен, и она начала стандартную химиотерапию. К тошноте и слабости присоединилось еще одно типичное осложнение: «прохимиченные мозги» — провалы в памяти. Она работала в школе и начала допускать ошибки.
Дальше так продолжаться не может, решила больная: «это лечение произвело хаос в моем организме». Сначала рак молочной железы с метастазами в печень отступал, но вскоре обнаружились новые метастазы в кости и легкие. «Химиотерапия придушила один очаг, но появились новые».
Мария считала, что ей осталось месяцев шесть — не больше.
Счетчик заработал
Таргетированная терапия
Миссис Дугиль знала, что генетические методы борьбы с раком развиваются стремительно.
Доктор Кич говорит: «Это научная революция! Это было известно уже 20 лет, но сейчас произошел информационный взрыв!»
Первый шаг генной онкологии — осмысление роли ДНК. Процесс развития рака в организме построен на поломках в ДНК.
- Есть несколько типов повреждений генов. Некоторые передаются по наследству. Актриса Анжелина Джоли стала символом онкогенной рекламы. У нее нашли мутацию онкогена BRCA1 связанную с раком молочной железы, яичников, матки. У нее не было признаков рака, но она решила подвергнется удалению молочных желез с профилактической целью, так как ее мама,бабушка и тетя умерли от рака. Ей была выполнена двухсторонняя мастэктомия в 2013 голу.
- Другой тип мутирования генов не передается по наследству, но под определенным воздействием проявляется. Это «драйв мутации». Например, курение может вызвать рак легких.
Ученые поняли, что найдя мутацию, можно подобрать и лечение, нацеленное (таргетированное) на нее. Это привело к созданию новых лекарств, разработанных для таргетированной терапии. Для врачей, которые как Кич, работают в онкологии 30 лет, это было потрясающим открытием.
«Мы получили то, что так долго ждали. Первыми шагами в 80х-90х годах было открытие рецепторов эстрогена в ткани раковой опухоли молочной железы. Тогда была разработана гормональная терапия рака молочной железы.
Ее назначали не всем подряд, а только тем, у кого была чувствительность к гормональной терапии. Это был колоссальный прогресс в лечении рака груди. Позднее в 1998 году был создан Ритуксимаб, препарат генной инженерии, который подавляет размножение лимфомы.
Это коренным образом изменило подход к лечению лимфом и лейкозов» — рассказывает Кич. «Позже в онкологию рака молочной железы пришел Герцептин ( трастузумаб).
Опухоли имеющие экспрессию гена HER2 очень агрессивны, их трудно лечить и они имеют плохой прогноз. Но трастузумаб перевернул наше представление об этом гене и о прогнозе рака».
В середине 2000х были разработаны сотни «лекарств малых молекул». Они блокируют рост раковых клеток и являются эффективными в лечении рака почки, некоторых форм рака легких, лейкоза, рака кожи. Это была принципиальная эволюция терапии рака.
В течении последних лет исследования сосредоточены вокруг так называемого «генетического профиля опухолей», который позволяет выявить конкретные мутации и их лечить.
Новые лекарственные препараты для таргетированной терапии приходят на рынок почти каждый день.
https://www.youtube.com/watch?v=xubeTPhRO8s
Онкология стала точной наукой. У конкретного больного определяется конкретная мутация и к ней подбирается таргетированный препарат.
Что же это означало для Марии? К лету прошлого года все возможности химиотерапии были исчерпаны. «Казалось нам уже нечего пробовать, но в этот момент мы получили новый более углубленный генетический анализ. Пациентка прошла тест и мы обнаружили «хит». Выяснилось, что у нее есть мутация, которая по всей видимости и являлась инициатором рака.
К этой мутации мы подобрали два препарата — Экземестан и Эверолимус. С августа прошлого года больная принимает их, и уже год она в полной ремиссии».
(Напомню, это четвертая стадия рака, прогноз обещал всего несколько месяцев жизни еще в 2012 году. В общей сложности больная живет с диагнозом рак с 1997 года, благодаря успешной терапии. примеч. автора)
Есть ли минусы у нового направления: таргетированной терапии и генетических исследований?
Рак является только одним из многих генетических заболеваний. И для многих заболеваний расшифровка генома позволит получить целевые лекарства.
Все ли так безоблачно?
Доктор Холланд говорит, что понятие «персонифицированной терапии» стало рекламным лозунгом для частных клиник.
В ноябре 2015 года американская организация за контролем качества лекарств FDA в докладе конгрессу США сообщила о том, что появилась тревожная тенденция, склонять пациентов к недостаточно достоверным и дорогостоящим лабораторным тестам, которые влекут за собой и дорогостоящее, но ненужное лечение.
В докладе FDA приведены примеры, когда к производителям тестов были предъявлены претензии в связи с низким качеством их продукции. Овочек, тест, который определял генетический код рака яичников давал ложноположительные результаты.
На основании теста было проведено ненужное удаление яичников у нескольких пациенток. Овочек никогда не был официально зарегистрированным в США. FDA предлагает ужесточить правил регистрации продуктов для генных исследований, и администрация президента дала понять, что это будет одобрено.
Таким образом, столкнулись «Корабль большой фарминдустрии с «персонифицированной медициной» на борту и государственный контроль США.
Единственное, где цены снизились — это тестирование. «Цены падают и доступностью этих тестов стремительно растет. То, что мы не могли даже представить еще вчера, сегодня вполне выполнимо.»
Тем не менее страховые компании отказываются компенсировать пациентам полное исследование генома. Но еще большую проблему доктор Холланд видит в эффективности препаратов. «Даже если мы находим мутацию гена, и знаем препарат для его лечения, не у всех пациентов можно получить ремиссию рака.
Есть больные, которые не реагируют даже на таргетированную терапию. Конечно, успешные случаи с Картером и миссис Дугиль обнадеживают, но в целом, эта отрасль онкологии находится еще в зародыше. Такие счастливые истории бывают.
Но остается не ясно, почему пациент с мутацией «Х» получал препарат «У» с положительным результатом, а другой пациент, с теми же данными, этих результатов не достиг.
Генетические исследования не отменили химиотерапию, облучение и другие стандартных методы лечения рака».
«Если опухоль дала метастазы, ее все равно можно лечить, но нельзя вылечить полностью»- говорит доктор Нехал Масуд, онколог клиники Мультикеа, специалист по лечению рака молочной железы. «К сожалению, можно потратить миллиарды долларов, но в один час болезнь возьмет свое. Это типично для большинства форм рака.
Пятилетняя выживаемость пациенток с раком молочной железы на начальном этапе -100%, а в 4 стадии 22% — данные Американской ассоциации рака. Опухоль должна быть по размеру не меньше 1/4 сушеного гороха, чтоб ее увидеть на компьютерной томографии»- сказал Масуд.
«Исключение — маммография, которая позволяет увидеть и более мелкие очаги. Вот почему маммография еще более важный инструмент для ранней диагностики рака.
Маммография выявляет опухоль до того, как она становится ощутимой или может быть определена КТ, скрининг позволил сохранить много жизней!
Нынче рак представляется таким заболеванием, как почечная недостаточность. Его нельзя вылечить, но можно продлить жизнь на многие годы, как при хроническом диализе».
Это уже не смертельный приговор, рак перешел в категорию хронических болезней.
Доктор Масуд говорит, что хотел бы использовать генетические исследования тогда, когда это нужно ему, он считает преждевременным назначать их всем подряд, так как эти исследования еще не проверены временем на свою достоверность и эффективность для таких распространенных патологий, как рак легких или рак толстой кишки. Когда будет собран огромный материал, чтобы предсказывать результат таргетированной терапии, тогда можно будет опираться на эти исследования. Доказательная медицина — ключ всему» — сказал Масуд.
«Все эти захватывающие истории о новых лекарственных средствах должны быть оценены по сравнению со стандартной терапией. Пока ничего нельзя сказать об отдаленной токсичности новых препаратов».
Доктор Холланд верит, как и все опрошенные врачи, что генетические мутации — основа раковых заболеваний. Будущее онкологии за генной инженерией, вопрос только времени!
Будущее Марии
Онкологи редко используют слово «вылечить», когда речь идет об отдельных случаях. Рак -хитрый враг, болезнь затаивается, переходит в ремиссию, но может вспыхнуть в любой момент. Рак дремал в организме Марии больше 10 лет прежде, чем вернуться с двойной силой.
В настоящее время судя по ее анализам, она не имеет никаких признаков рака, но анализы имеют свои пределы. Пациентка принимает лекарства и будет продолжать лечение, пока оно работает.
Хотя генетическое тесты могут помочь только некоторым больным, Мария — доказательство целесообразности этих исследований. «Если лечение работает, Вы покупаете время!» А для многодетной Марии время — очень важно.
«С 2010 я живу каждый день так, чтобы успеть сделать все, что только можно». Мария по прежнему работает в школе, живет с мужем и младшей дочерью в Гиг Харборе, старшие девочки окончили колледж.
«Это так важно, чтобы рядом были люди, которые заботятся о Вас» — сказала она. «Важно покончить с суетой в своей жизни, и жить осмысленно каждый день»
Крейг Сейлор. Олимпиан 2 декабря 2015г.
Перевод врача А.Новоциду
Targeting cancer with genomic tests. Craig Sailor: тел. 253-597-8541, @crsailor
Источник: http://onkomarkery.ru/lechenie-za-rubezhom/targetirovannaya-terapiya-raka-geneticheskie-issledovaniya.html
Генная терапия

В результате исследований учеными было выявлено, что одной из причин возникновения раковых клеток являются генетические изменения в организме. Ошибки в ДНК вызывают изменения в генах, в тех, которые контролируют деление клетки.
Появление повреждений в геноме приводит к перерождению нормальных клеток в раковые. Один из генов может повредиться настолько, что станет причиной неконтролируемого деления клеток, способствующего злокачественному перерожднению.
На более поздних стадиях клетки, отделяясь от опухоли, по кровеносному и лимфатическому руслу распространяются по всему организму, метастазируют. В настоящее время созданы специальные базы, объединенные в Атлас Ракового Генома, в которых занесены сведения о более чем 1,2 млн. генных мутаций.
Как работает генная терапия
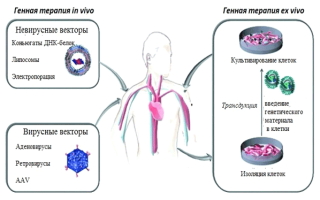
На базе научно-исследовательских институтов г.Москвы стремительно растет интерес к этому виду терапии, как наиболее эффективному и безопасному. Методика позволяет оперировать с онкоклетками как внутри организма (in vivo), так и вне его (ex vivo).
Генная терапия in vivo предполагает введение генов в пораженные клетки. Терапия ex vivo предполагает выделение клеток из костного мозга пациента с последующим введением в них здорового гена, в результате полученный материал вводится в опухолевую ткань или в клетки иммунной системы. Этот процесс осуществляют специальные векторы, которые были созданы при помощи генной инженерии.
Как взаимодействуют гены и вирусы
Перенос генетического материала из одной клетки в другую проводится с помощью вирусов. В большинстве случаев применяют распространенные типы носителей – вирусы кори, оспы, так как они имеют свойство доставлять внутрь ткани генетический материал.
Эти вирусы модифицируют, для того чтобы они не заразили пациента. Все негативные последствия направлены на больные клетки, без воздействия на здоровые.
Важным фактором применения данной методики является ее безопасность и отсутствие рисков бесконтрольного распространения пораженной вирусом ДНК.
Электропорация
Популярная методика невирусной доставки предполагает воздействие на поверхность клеток тканей посредством электрических импульсов, в результате чего наблюдается образование мелких пор, сквозь которые внутрь клеток легко проникают плазмидные ДНК. Данная методика идеально подходит для лечения как первичных, так и метастатичных опухолей.
Выбор методики лечения
Учитывая тип и размеры опухоли, стадию развития заболевания, а также индивидуальные особенности организма пациента, врач выбирает методику и разрабатывает индивидуальную схему лечения. В настоящее время к применению возможны следующие техники:
• Пролекарственная ГТ, которая заключается во введении специальных генов, именуемых «суицидными», в опухолевые ткани. В результате активной деятельности последних онкоклетки неизбежно погибают. Недостатком данной методики является постепенная адаптация раковых клеток к повреждающему их пролекарству.
• Онколитическая вирусная ГТ, базирующаяся на использовании вирусов, которые в результате генетических изменений становятся онколитическими, то есть способными воздействовать на пораженные клетки, но безвредными для здоровых тканей.
Данная методика обладает важным преимуществом перед остальными из-за возможности быстрого распространения онколитических вирусов по всему организму посредством кровеносных сосудов.
Это обеспечивает проникновение вирусов как в очаг опухолевого поражения, так и в отдаленные метастазы.
Заключение
Эволюционные подходы к разработкам методик лечения рака позволяют утверждать, что уже сегодня на смену традиционным методам лечения приходит персонализированная медицина. В результате для каждого пациента подбирается индивидуальная программа терапии, отличающиеся безопасностью и высокой эффективностью. Одной из таких программ является генная терапия.
Источник: http://tumor-clinic.ru/vaktsinoterapiya/gennaya-terapiya/
Генная терапия в онкологии
Как научный метод лечения болезней генная терапия очень молода. Считается, что начало этому направлению исследований было положено в 1970 году.
А реальным “днем рождения” стал день 14 сентября 1990 года, когда впервые был получен результат в лечении первичного иммунодефицита (у четырехлетней девочки).
В разработку темы с тех лет вкладывается огромное количество денег, поскольку считается, что генотерапия может вскоре стать чуть ли не основным методом лечения.
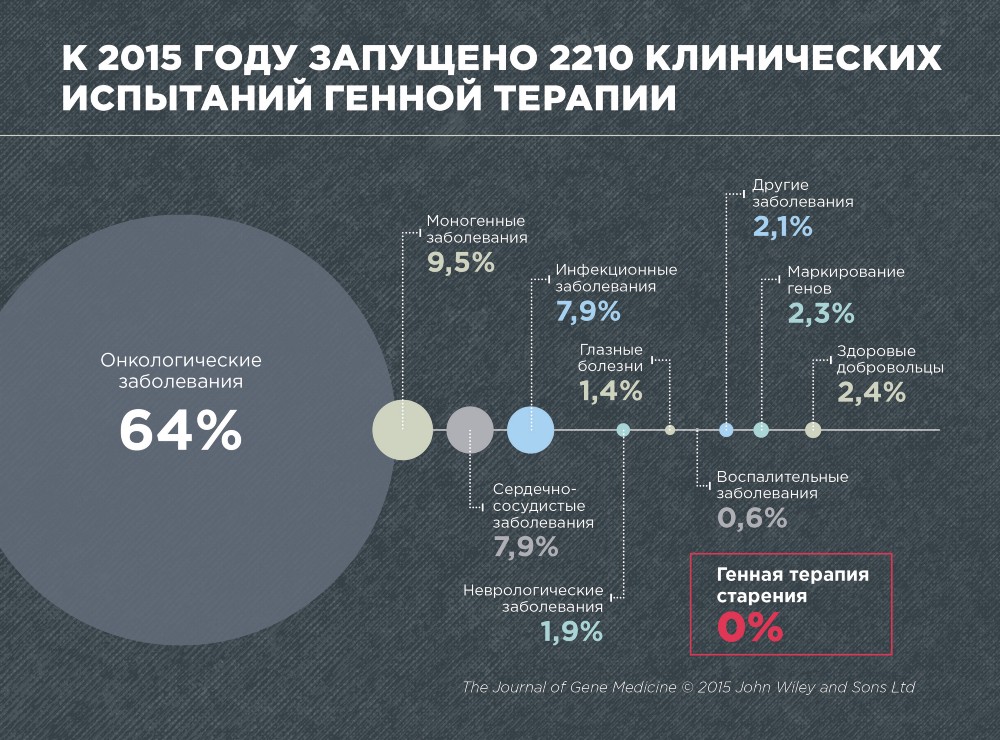
Отрадно заметить, что в проекте “Геном человека” (стартовал в 1988 году) с 1989 года участвуют и российские медики. Учитывая перспективность методов генной инженерии, 64% всех исследовательских усилий в мире по генной терапии прикладывается к теме лечение рака.
Экспериментальные формы лечения методами генотерапии связаны с введением генетического материала (ДНК или РНК) в живые клетки. Генная терапия уже находится на практическом уровне, когда проводятся клинические испытания для многих видов рака.
В общем случае, генетический материал не может быть вставлен непосредственно в клетки человека. Вместо этого, он будет доставлен к клеткам с помощью носителя, который имеет специфическое название в генной инженерии «вектор».
Векторы, наиболее часто используемые в генной терапии, это вирусы, потому что они имеют уникальную способность распознавать определенные клетки и вставлять в них генетический материал.
Ученые изменяют эти вирусы, чтобы сделать их более безопасными для человека (например, путем инактивации генов, которые позволяют им размножаться или вызывать заболевание) и / или для улучшения их способности распознавать и воздействовать на клетки-мишени. Разнообразие липосом (жирные частицы) и наночастиц также используется в качестве направлений для исследований в генной терапии, и ученые изучают методы взаимосвязи этих направлений с конкретными типами клеток.
Исследователи изучают несколько методов лечения рака с помощью генной терапии. Некоторые подходы связаны с тем, чтобы уничтожить раковые клетки или предотвратить их рост.
Внимание в других подходах направлено на здоровые клетки, чтобы повысить их способность бороться с раком.
В некоторых случаях, исследователи берут клетки от пациента, воздействуют на них с помощью вектора в лаборатории, и возвращают клетки к пациенту. В частности, вектор задается непосредственно пациенту.
Некоторые изучаемые генной терапией подходы описаны ниже.
o Замена измененного Ген-супрессора опухолей, который производит нефункциональный белок (или белок вообще отсутствует) на нормальную версию гена. Поскольку гены-супрессоры опухоли (например, TP53 ) играют важную роль в предотвращении рака, восстановление нормальной функции этих генов может ингибировать (замедлить) рост рака или способствовать регрессии рака.
o Введение генетического материала, чтобы блокировать экспрессию онкогена чей продукт способствует росту опухоли.
Короткие РНК или молекулы ДНК с комплементарными последовательностями в матричной РНК гена (мРНК) могут быть упакованы в векторы или введены в клетки непосредственно.
Эти короткие молекулы, называемые олигонуклеотиды, могут связываться с мРНК-мишенями, предотвращая их перевод в белок или даже вызывая их деградацию.
o Улучшение у пациента иммунного ответа раку. В одном подходе, генная терапия используется для введения цитокинов, продуцирующих гены в раковых клетках, чтобы стимулировать иммунный ответ на опухоль.
o Вставка генов в раковые клетки, чтобы сделать их более чувствительными к химиотерапии, лучевой терапии, или к другому лечению.
o Вставка генов в здоровые кроветворные стволовые клетки, чтобы сделать их более устойчивыми к побочным эффектам от лечения рака, таким как высокие дозы противоопухолевых препаратов.
o Вставка «генов самоликвидации» в раковые клетки пациента.
Ген самоликвидации представляет собой ген, чей продукт может активировать «пролекарство» (неактивный вид токсического препарата), в результате чего токсичное лекарственное средство, производится только в раковых клетках у пациентов, с учетом пролекарства. Нормальные клетки, которые не имеют гена самоликвидации, не воспринимают действие пропрепарата (токсичного препарата).
o Вставка генов для предотвращения выращивания раковыми клетками новых кровеносных сосудов (ангиогенез).
Предлагаемые генной терапией клинические испытания, или протоколы, должны быть одобрены не менее чем двумя наблюдательными советами при учреждении команды исследователей, прежде чем они могут быть проведены.
Протоколы генной терапии также должны быть одобрены FDA, которая регулирует все продукты генной терапии. Это к тому, что допуск продукта генотерапии для всеобщего применения весьма строго контролируется.
Хотя и в этом контроле иногда находятся “дыры”.
Источник: http://prostovita.ru/lechenie-onkologii/biologicheskaia-terapia/gennaya-terapiya.html