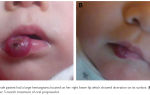
Миелодиспластический синдром
Миелодиспластический синдром – группа гематологических заболеваний, при которых наблюдаются цитопения, диспластические изменения костного мозга и высокий риск возникновения острого лейкоза. Характерные симптомы отсутствуют, выявляются признаки анемии, нейтропении и тромбоцитопении.
Диагноз устанавливается с учетом данных лабораторных анализов: полного анализа периферической крови, гистологического и цитологического исследования биоптата и аспирата костного мозга и т. д. Дифференциальный диагноз может представлять значительные затруднения.
Лечение – переливание компонентов крови, химиотерапия, иммуносупрессивная терапия, пересадка костного мозга.
Миелодиспластический синдром – группа заболеваний и состояний с нарушениями миелоидного кроветворения и высоким риском развития острого лейкоза. Вероятность развития увеличивается с возрастом, в 80% случаев данный синдром диагностируется у людей старше 60 лет.
Мужчины страдают несколько чаще женщин. У детей миелодиспластический синдром практически не встречается. В последние десятилетия гематологи отмечают увеличение заболеваемости среди лиц трудоспособного возраста.
Предполагается, что причиной «омоложения» болезни могло стать существенное ухудшение экологической обстановки.
До недавнего времени лечение миелодиспластического синдрома было только симптоматическим.
Сегодня специалисты разрабатывают новые методы терапии, однако эффективное лечение этой группы болезней все еще остается одной из самых сложных проблем современной гематологии.
Пока прогноз при миелодиспластическом синдроме, в основном, зависит от особенностей течения болезни, наличия или отсутствия осложнений. Лечение осуществляют специалисты в сфере онкологии и гематологии.
Причины и классификация миелодиспластического синдрома
С учетом причин развития различают два типа миелодиспластического синдрома: первичный (идиопатический) и вторичный. Идиопатический вариант выявляется в 80-90% случаев, диагностируется преимущественно у пациентов старше 60 лет. Причины возникновения установить не удается.
В числе факторов риска первичного миелодиспластического синдрома – курение, повышенный уровень радиации при выполнении профессиональных обязанностей или проживании в неблагоприятной экологической зоне, частый контакт с бензином, пестицидами и органическими растворителям, некоторые наследственные и врожденные заболевания (нейрофиброматоз, анемия Фанкони, синдром Дауна).
Вторичный вариант миелодиспластического синдрома наблюдается в 10-20% случаев, может возникать в любом возрасте. Причиной развития становится химиотерапия или радиотерапия по поводу какого-то онкологического заболевания.
В число лекарственных средств с доказанной способностью вызывать миелодиспластический синдром включают циклофосфан, подофиллотоксины, антрациклины (доксорубицин) и ингибиторы топоизомеразы (иринотекан, топотекан).
Вторичный вариант отличается более высокой резистентностью к лечению, более высоким риском развития острого лейкоза и более неблагоприятным прогнозом.
В современной редакции классификации ВОЗ различают следующие типы миелодиспластического синдрома:
- Рефрактерная анемия. Сохраняется более полугода. В анализе крови бласты отсутствуют либо единичные. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная анемия с кольцевыми сидеробластами. Сохраняется более полугода. В анализе крови бласты отсутствуют. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная цитопения с многолинейной дисплазией. В анализе крови тельца Ауэра отсутствуют, бласты отсутствуют либо единичные, выявляются панцитопения и увеличение количества моноцитов. В костном мозге диспластические изменения менее 10% клеток в 1 миелоидной клеточной линии, бластов менее 5%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-1. В анализе крови тельца Ауэра отсутствуют, бластов более 5%, цитопения и увеличение количества моноцитов. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 5-9%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-2. В анализе крови увеличение количества моноцитов, цитопения, бластов 5-19%, могут выявляться тельца Ауэра. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 10-19%, обнаруживаются тельца Ауэра.
- Неклассифицируемый миелодиспластический синдром. В анализе крови цитопения, бласты отсутствуют либо единичные, тельца Ауэра отсутствуют. В костном мозге дисплазия одного мегакариоцитарного либо гранулоцитарного ростка, бластов более 5%, тельца Ауэра отсутствуют.
- Миелодиспластический синдром, ассоциированный с изолированной делецией 5q. В анализе крови анемия, бластов более 5%, возможен тромбоцитоз. В костном мозге более 5% бластов, тельца Ауэра отсутствуют, изолированная делеция 5q.
Клиническая симптоматика определяется степенью нарушений миелопоэза. При мягко протекающих расстройствах возможно длительное бессимптомное или стертое течение.
Из-за слабой выраженности клинических проявлений некоторые больные не обращаются к врачам, и миелодиспластический синдром обнаруживается во время проведения очередного медицинского осмотра.
При преобладании анемии наблюдаются слабость, одышка, плохая переносимость физических нагрузок, бледность кожных покровов, головокружения и обморочные состояния.
При миелодиспластическом синдроме с тромбоцитопенией возникает повышенная кровоточивость, отмечаются десневые и носовые кровотечения, на коже появляются петехии. Возможны подкожные кровоизлияния и меноррагии.
Миелодиспластический синдром с выраженными нейтропенией и агранулоцитозом проявляется частыми простудами, стоматитом, синуситом или стрептодермией. В тяжелых случаях возможно развитие пневмонии или сепсиса. Инфекционные заболевания нередко вызываются грибками, вирусами или условно-патогенными микробами.
У каждого пятого пациента с миелодиспластическим синдромом выявляется увеличение лимфоузлов, селезенки и печени.
Диагностика миелодиспластического синдрома
Диагноз выставляется с учетом данных лабораторных исследований: анализа периферической крови, биопсии костного мозга с последующим цитологическим исследованием, цитохимических и цитогенетических тестов.
В анализе периферической крови больных миелодиспластическим синдромом обычно обнаруживается панцитопения, реже выявляется дву- или одноростковая цитопения. У 90% пациентов наблюдается нормоцитарная либо макроцитарная анемия, у 60% – нейтропения и лейкопения.
У большинства больных миелодиспластическим синдромом отмечается тромбоцитопения.
При исследовании костного мозга количество клеток обычно нормальное либо повышенное. Уже на ранних стадиях обнаруживаются признаки дизэритропоэза. Количество бластов зависит от формы миелодиспластического синдрома, может быть нормальным либо увеличенным. В последующем наблюдаются дисгранулоцитопоэз и дисмегакариоцитопоэз.
У некоторых больных признаки дисплазии костного мозга выражены очень слабо. В процессе цитогенетического исследования у ¾ больных выявляются хромосомные нарушения.
Дифференциальный диагноз миелодиспластического синдрома проводят с В12-дефицитной анемией, фолиево-дефицитной анемией, апластической анемией, острым миелолейкозом и другими острыми лейкозами.
Тактика лечения определяется выраженностью клинической симптоматики и лабораторных изменений. При отсутствии явных признаков анемии, геморрагического синдрома и инфекционных осложнений осуществляется наблюдение.
При миелодиспластическом синдроме с выраженной анемией, тромбоцитопенией и нейтропенией, а также при высоком риске возникновения острого лейкоза назначают сопроводительную терапию, химиотерапию и иммуносупрессивную терапию.
При необходимости осуществляют пересадку костного мозга.
Сопроводительная терапия является самым распространенным методом лечения миелодиспластического синдрома. Предусматривает внутривенные инфузии компонентов крови.
При длительном применении может провоцировать повышение уровня железа, влекущее за собой нарушения деятельности жизненно важных органов, поэтому переливания гемокомпонентов производят при одновременном приеме хелаторов (лекарственных средств, связывающих железо и способствующих его выведению).
Иммуносупрессоры эффективны при лечении миелодиспластического синдрома с отсутствием хромосомных аномалий, наличием гена HLA-DR15 и гипоклеточном костном мозге. Химиотерапию применяют при невозможности трансплантации костного мозга.
Высокие дозы препаратов используют при трансформации миелодиспластического синдрома в острый лейкоз, а также при рефрактерных анемиях с избытком бластов при нормоклеточном и гиперклеточном костном мозге, низкие – при невозможности пересадки костного мозга.
Наряду с перечисленными средствами пациентам назначают гипометилирующие средства (азацитидин). Наиболее надежным способом достижения полноценной длительной ремиссии является трансплантация костного мозга.
Прогноз зависит от типа миелодиспластического синдрома, количества хромосомных аномалий, необходимости в регулярных переливаниях компонентов крови, выраженности клинических проявлений и наличия осложнений. Различают 5 групп риска.
Средняя выживаемость больных миелодиспластическим синдромом, входящих в группу с самым низким уровнем риска, составляет более 11 лет; с самым высоким – около 8 месяцев.
Вероятность отторжения костного мозга после трансплантации – около 10%.
Источник: http://www.krasotaimedicina.ru/diseases/oncologic/myelodysplastic-syndrome
Признаки и симптомы миелодиспластического синдрома
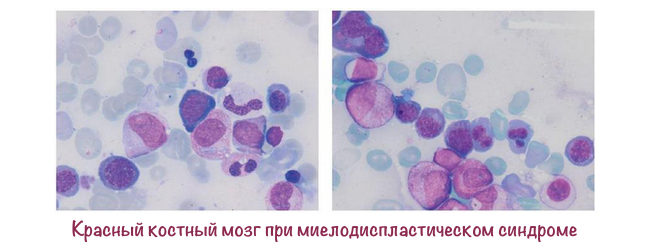
Суть болезни
Миелодиспластические синдромы (МДС) – группа заболеваний, которые характеризуются нарушениями кроветворения миелоидной линии. В результате этих нарушений возможность выработки зрелых клеток крови частично сохраняется, но наблюдается дефицит тех или иных их видов, а сами клетки при этом изменены и плохо функционируют.
У значительной части больных МДС через некоторый промежуток времени, обычно от нескольких месяцев до нескольких лет, развивается острый миелоидный лейкоз .
МДС в обиходе иногда называют «предлейкемией», ранее применялись также термины «малопроцентный лейкоз», «тлеющий лейкоз» или «дремлющий лейкоз». Это связано с содержанием бластных клеток в костном мозге.
если их более 20% (согласно классификации Всемирной организации здравоохранения) или более 30% (согласно франко-американо-британской классификации FAB), то речь уже идет о миелоидном лейкозе, если же их уровень ниже порогового значения, то может быть диагностирован МДС.
Под термином «миелодиспластический синдром» в настоящее время подразумевается целая группа заболеваний, различающихся по частоте встречаемости, клиническим проявлениям, а также по вероятности и ожидаемым срокам трансформации в лейкоз. Специалисты используют две классификации МДС: франко-американо-британскую (FAB) и классификацию Всемирной организации здравоохранения (ВОЗ). Рассмотрим классификацию FAB как более простую:
- Рефрактерная анемия (РА). Термин «рефрактерная» здесь означает, что анемия не поддается лечению препаратами железа и витаминами. В костном мозге менее 5% миелобластов. аномалии в основном касаются предшественников эритроцитов .
- Рефрактерная анемия с кольцевыми сидеробластами (РАКС): миелобластов в костном мозге менее 5%, но не менее 15% предшественников эритроцитов представлены особыми аномальными клетками – так называемыми кольцевыми сидеробластами. Это клетки с кольцеобразными «отложениями» железа, которые не могут обеспечивать эффективный транспорт кислорода.
- Рефрактерная анемия с избытком бластов (РАИБ): миелобластов в костном мозге 5–20%. В классификации ВОЗ дополнительно подразделяется на РАИБ-I (5–9% бластов) и РАИБ-II (10-19% бластов).
- Рефрактерная анемия с избытком бластов на стадии трансформации (РАИБ-T): миелобластов 21–30% (по классификации ВОЗ это уже острый миелоидный лейкоз).
- Хронический миеломоноцитарный лейкоз, ХММЛ (по классификации ВОЗ относится к миелодиспластическим-миелопролиферативным заболеваниям).
Частота встречаемости, факторы риска
Общая частота МДС составляет 3-5 случаев на 100 000 населения. Однако у детей и молодых взрослых это заболевание встречается во много раз реже: более 80% случаев МДС фиксируется после 60 лет, причем несколько чаще у мужчин, чем у женщин.
В большинстве случаев МДС возникает без какой-либо известной причины, но иногда его развитие может быть спровоцировано предшествующей химиотерапией или лучевой терапией по поводу какой-либо опухоли – например, лимфогранулематоза или неходжкинской лимфомы. В этих случаях говорят о вторичном МДС .
Частота МДС (как и острого миелоидного лейкоза ) повышена у людей с определенными генетическими аномалиями, такими как синдром Дауна, анемия Фанкони. нейрофиброматоз и некоторые другие.
Изучается роль и других факторов в возникновении этого заболевания – например, воздействия некоторых вредных химических веществ. Но у детей и молодых взрослых эти факторы не играют существенной роли.
Признаки и симптомы
Симптомы и степень их выраженности могут различаться в зависимости от разновидности МДС и конкретного случая. Но большинство наблюдаемых проявлений возникает в результате цитопении. то есть дефицита нормальных клеток крови .
Анемия (недостаток эритроцитов. сниженный уровень гемоглобина ) характерна для подавляющего большинства случаев МДС; она проявляется бледностью, утомляемостью, плохой переносимостью физических нагрузок; могут также возникнуть одышка, головокружения, боли в груди и т.п.
Примерно у половины больных встречается нейтропения (то есть пониженное содержание зрелых функциональных нейтрофилов ) и поэтому снижена сопротивляемость инфекциям; может обнаруживаться стойкое повышение температуры. Нередко наблюдается и тромбоцитопения. то есть недостаточное содержание тромбоцитов. что ведет к возникновению кровотечений, синяков, петехий (мелкоточечных подкожных кровоизлияний). Возможны и другие симптомы.
Впрочем, в некоторых случаях пациенты с МДС долгое время не замечают существенного ухудшения самочувствия, и тогда проблемы обнаруживаются только в ходе обычного медосмотра по отклонениям от нормы в клиническом анализе крови .
Диагностика
Как правило, поводом к медицинскому осмотру служат жалобы на симптомы, связанные с анемией. причем эта анемия не поддается обычному лечению препаратами железа и витаминами. В клиническом анализе крови снижено количество эритроцитов.
может быть также снижено количество лейкоцитов (нейтрофилов ) и/или тромбоцитов. Характерно, что при уменьшении числа эритроцитов их размеры и цветовой показатель крови могут быть увеличены.
Полезен также подсчет числа ретикулоцитов – незрелых эритроцитов, так как он дает информацию об интенсивности образования новых красных клеток крови.
Для точной диагностики и определения конкретной разновидности МДС необходимо детальное исследование образца костного мозга. взятого в ходе трепанобиопсии. анализируются характер расположения различных клеток («архитектоника» костного мозга), число бластных клеток.
содержание кольцевых сидеробластов и других аномальных клеток, степень изменений во всех ростках кроветворения – то есть среди предшественников эритроцитов, гранулоцитов и тромбоцитов, изменения стромы – соединительной ткани костного мозга.
Выявленные нарушения могут быть очень разнообразными.
Так как развитие МДС нередко связано с известными хромосомными аномалиями, определенную роль в диагностике и прогнозе играют цитогенетические исследования .
Лечение
Лечение МДС зависит от его конкретной формы.
Так, если речь идет об относительно «доброкачественных» разновидностях МДС с небольшим числом бластных клеток, то больные из групп низкого риска могут длительное время сохранять нормальное качество жизни, просто время от времени получая заместительную терапию компонентами крови – эритроцитами и, возможно, тромбоцитами.
При перегрузке железом после множественных переливаний необходима соответствующая терапия (десферал, эксиджад). Иногда для стимуляции кроветворения используют факторы роста. При инфекционных осложнениях требуется антибактериальная и противогрибковая терапия. В ряде случаев применяют и другие лекарственные средства.
Если же речь идет о формах болезни, связанных с более высоким риском, то вопрос о лечении таких пацентов достаточно сложен. Химиотерапия с использованием обычных цитостатиков (цитарабин и т.п.) малоэффективна и не приводит к долговременной ремиссии.
Общепринятых стандартов химиотерапии при МДС практически не существует. Разрабатываются новые лекарства; в частности, обнадеживающие результаты показало применение дакогена (децитабина). Иногда может применяться иммуносупрессивная терапия и другие методы.
Единственным методом, позволяющим в случае успеха рассчитывать на полное излечение больных с МДС, является аллогенная трансплантация костного мозга – особенно у молодых пациентов, которые лучше переносят эту процедуру и связанные с ней осложнения. Однако аллогенная трансплантация по поводу МДС, как и по поводу других заболеваний, связана с проблемой поиска совместимого донора и с опасностью жизнеугрожающих осложнений.
При трансформации МДС в острый миелоидный лейкоз проводится химиотерапия этого лейкоза. Однако вторичный лейкоз, развившийся из МДС, обычно плохо поддается терапии. В этой ситуации, как правило, также показано проведение аллогенной трансплантации костного мозга, особенно у молодых больных.
Прогноз
Развитие МДС происходит с разной скоростью в зависимости от конкретной разновидности болезни. Если при некоторых формах МДС пациенты могут, особенно при наличии поддерживающей терапии (переливания эритроцитов и т.д.
), прожить 5-10 лет, то при более «активных» и злокачественных разновидностях заболевания средняя продолжительность жизни составляет не более года. Особенно плохой прогноз при вторичном МДС.
Пациенты могут погибнуть как от проявлений самого МДС, так и от развившегося на его основе острого миелоидного лейкоза.
При использовании аллогенной трансплантации костного мозга можно добиться нормализации кроветворения и стойкой ремиссии болезни более чем у половины молодых пациентов. Иными словами, в случае успеха трансплантация приводит к выздоровлению. Однако надо помнить о высокой вероятности жизнеугрожающих осложнений (таких как реакция «трансплантат против хозяина» ) и рецидивов после трансплантации.
Источник: http://therapycancer.ru/mieloma/1868-priznaki-i-simptomy-mielodisplasticheskogo-sindroma
Миелодиспластический синдром: причины, признаки, диагностика, как лечить, прогноз
Содержание:
Миелодиспластический синдром (МДС) — тяжелое гематологическое заболевание, которое относится к группе онкопатологий и плохо поддается терапии. В основе недуга лежит нарушение процесса воспроизведения клеток крови: их развития и деления.
В результате подобных аномалий образуются онкологические структуры, и формируются незрелые бласты. Постепенно количество нормально функционирующих, зрелых клеток в организме уменьшается.
Данный синдром называют «дремлющим лейкозом» из-за скопления в крови бластных клеток.
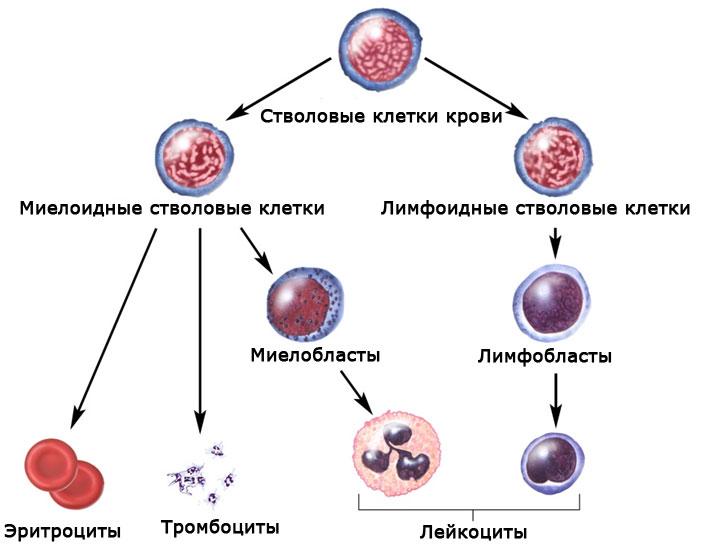
Костный мозг — важный кроветворный орган, в котором происходят процессы образования, развития и созревания клеток крови, то есть осуществляется гемопоэз. Этот орган также принимает участие в иммунопоэзе — процессе созревания иммунокомпетентных клеток. У взрослого человека в костном мозге содержатся незрелые, недифференцированные и низкодифференцированные клетки – стволовые.
Большинство заболеваний костного мозга обусловлены мутацией стволовой клетки крови и нарушением ее дифференциации. МДС не является исключением. Расстройство кроветворения приводит к развитию острого лейкоза. Причина первичного МДС неизвестна.
Мутагенные факторы оказывают негативное воздействие на стволовую клетку крови, что приводит к нарушению ДНК и выработке в костном мозге аномальных клеток, постепенно вытесняющих нормальные.
Вторичный синдром развивается в результате длительного лечения цитостатиками, при частом контактировании с химическими веществами, в следствии облучения. Заболевание чаще развивается у пожилых лиц старше 60 лет, чаще у мужчин. Раньше среди детей синдром практически не встречался.
В настоящее время недуг «помолодел». Все чаще случаи МДС наблюдаются у больных среднего возраста, что связано с экологическими проблемами крупных городов. Миелодиспластический синдром имеет код по МКБ-10 D46.
Цитопения — клиническое проявление патологий системы кроветворения. Симптоматика недуга определяется поражением определенной клеточной линии. У больных возникает слабость, утомляемость, бледность, головокружение, лихорадка, кровоточивость, кровоизлияния.
Специфические признаки при этом отсутствуют. Диагностика патологии основывается на результатах гемограммы и гистологического исследования биоптата костного мозга.
Лечение заключается в переливании основных компонентов крови, проведении химиотерапии, иммуносупрессивной терапии и пересадке костного мозга.
цитопения с нарушением созревания клеток крови по нескольким росткам
Эффективное лечение МДС — одна из самых сложных проблем современной медицины. Его проводят специалисты в области онкогематологии. Синдром в запущенных случаях приводит к онкологии. Но так происходит не всегда. Легкие формы недуга типа рефракционной анемии обычно не заканчиваются формированием рака.
Недостаток клеток крови приводит к анемии, кровоточивости, сердечной дисфункции, увеличению риска развития инфекционных заболеваний. Прогноз МДС определяется особенностями течения патологического процесса, своевременностью диагностических и общетерапевтических мероприятий.
Своевременная терапия — единственный реальный шанс сохранить и продлить жизнь больных.
Этиология и патогенез
Гемопоэз — процесс кроветворения, который заключается в образовании и созревании клеток крови. Он происходит непрерывно, что связано с коротким сроком жизни клеток: от нескольких дней до 3-4 месяцев.
Ежедневно в живом организме синтезируется огромное количество новых кровяных телец из клеток-предшественников. В процессе миелопоэза образуются миелоидные клетки — эритроцитарные, лейкоцитарные и тромбоцитарные клеточные элементы.
Под воздействием негативных экзогенных и эндогенных факторов в костном мозге происходят патологические изменения, возникает расстройство кроветворения.
Этиология и патогенез МДС в настоящее время полностью не изучены. Ученые установили факторы, провоцирующие развитие патологии:
- загрязнения окружающей среды,
- радиоактивное излучение,
- табакокурение,
- опасные и вредные производственные факторы,
- контакты с агрессивными веществами,
- длительное проведение иммуносупрессивной терапии,
- врожденные генетические заболевания.
Первичный или идиопатический синдром — недуг невыясненной этиологии, который развивается в 80% случаев у лиц в возрасте 60-65 лет.
Вторичный синдром обусловлен воздействием на организм химиотерапевтических препаратов или лучевой терапии. Эта форма обычно развивается у молодых людей, быстро прогрессирует, отличается высокой устойчивостью к лечению и максимальным риском развития острого лейкоза.
В костном мозге вырабатываются все клеточные элементы крови. Там они находятся в незрелом состоянии, то есть являются предшественниками зрелых форм.
По мере необходимости каждая из них превращается в полноценные клетки и выполняет жизненно важные функции, от которых зависит процесс дыхания, гемостаз, иммунная защита.
При МДС стволовые клетки погибают до выхода в кровяное русло и не достигают своей функциональной зрелости. Это приводит к дефициту нормальных клеточных форм в крови и нарушению их функций, связанному с клеточной дисплазией.
Симптоматические проявления
МДС не имеет специфической симптоматики. Его клинические проявления определяются степенью тяжести и формой недуга.
- Анемический синдром — постоянный и обязательный признак патологии. Для него характерны гиперхромия и макроцитоз. Большой размер эритроцитов и их интенсивное окрашивание, зависящее от повышенного содержания гемоглобина, — признаки анемии при МДС и остром лейкозе. При анемии больные быстро утомляются, плохо переносят физические нагрузки, жалуются на головокружение, одышку, боль в груди, костях и суставах, невозможность сосредоточится. Их кожа становится бледной, ухудшается аппетит, снижается вес и работоспособность, возникает нервозность, цефалгия, дрожь в теле, шум в ушах, сонливость, тахикардия, обмороки. Плохо переносят анемию престарелые больные, а также лица с сердечно-легочной патологией. У них могут развиться тяжелые последствия — стенокардия, инфаркт миокарда, аритмии.
- Нейтропения характеризуется лихорадкой, снижением сопротивляемости организма к патогенным биологическим агентам, частым развитием инфекционных заболеваний бактериальной и вирусной этиологии. У больных повышается температура тела, потливость, возникает слабость, увеличиваются лимфоузлы. Сепсис и пневмония у таких пациентов часто заканчиваются летальным исходом.
- При тромбоцитопении кровоточат десна, появляются гематомы и петехии, часто течет кровь из носа, возникают длительные кровотечения после мелких хирургических вмешательств и различных инвазивных манипуляций. Возможно развитие внутренних кровотечений, меноррагий, кровоизлияний в головной мозг. Массивная потеря крови часто становится причиной смерти пациентов.
- У больных возникает лимфаденит, гепатомегалия, спленомегалия, специфическое поражение кожи — лейкемиды.
Диагностика
Диагноз МДС ставят после проведения лабораторного исследования периферической крови и гистологического исследования биоптата костного мозга. Специалисты изучают образ жизни больного, его анамнез, наличие профессиональных вредностей.
наиболее достоверный диагностический метод — трепанбиопсия костного мозга
Диагностические методы при МДС:
- гемограмма — анемия, лейкопения, нейтропения, моноцитоз; панцитопения — абсолютное показание для цитологического исследования костного мозга;
- биохимия крови — определение уровня железа, фолиевой кислоты, эритропоэтина, ЛДГ и АСТ, АЛТ, щелочной фосфатазы, мочевины;
- иммунограмма — специальный комплексный анализ, позволяющий определить, в каком состоянии находится иммунная система;
- гистология костного мозга выявляет деструкцию ткани, очаги поражения, наличие аномальных клеток, дисбаланс кроветворной и жировой ткани, гиперплазию всех ростков кроветворения, признаки дисплазии клеток;
- цитохимическое исследование — нарушение обмена микроэлементов и витаминов: щелочной фосфатазы в лейкоцитах, миелопероксидазы, железа;
- цитогенетический анализ — выявление хромосомных аномалий;
- дополнительные инструментальные исследования, позволяющие оценить состояние внутренних органов — УЗИ, КТ и МРТ.
Лечение
Интенсивное лечение МДС заключается в применении целого комплекса мероприятий. В тяжелых случаях медикаментозную терапию проводят в условиях стационара.
Больные с более легкими формами синдрома лечатся амбулаторно или на дневном стационаре. Основными среди общетерапевтических мероприятий являются химиотерапия и иммуносупрессивные методики.
Трансплантация костного мозга проводится при тяжелом течении болезни и повышает шансы больных на выздоровление.
Лечение МДС проводится с целю нормализации показателей периферической крови, устранения симптомов патологии, предупреждения трансформации недуга в острый лейкоз, улучшения и продления жизни больных.
Симптоматическая терапия направлена на устранение клинических проявлений синдрома и сопутствующих заболеваний, осложняющих течение основного недуга.
- Внутривенное капельное введение кровяных ингредиентов — тромбоконцентрата или эритроцитарной массы. Тромбоцитарную массу переливают редко.
- Для профилактики гемосидероза — «Дисферал».
- Иммуносупрессоры — «Леналидомид», антитимоцитарный и антилимфоцитарный глобулин, «Циклоспорин А», комбинации глюкокортикоидов.
- Химиотерапевтические средства — «Цитарабин», «Дакоген», «Мельфалан».
- Препараты-стимуляторы эритропоэза — железосодержащие препараты: «Ферроплекс», «Фенюльс», «Сорбифер дурулес»; препараты витаминов: «Цианкобаламин», «Фолиевая кислота»; анаболики-стероиды: «Анаполон», «Нандролон»; препараты эритропоэтина: «Эральфон», «Эпокомб»
- Стимуляторы лейкопоэза — «Нейпоген», «Лейкоген», «Метилурацил», «Интерлейкин».
- Ингибирование апоптоза — естественной гибели клеток — «Сандиммун», «Весаноид».
- Ингибиторы развития кровеносных сосудов — «Талидамид», «Ревлимид».
- Гипометилирующие средства — «Азацитидин».
- При развитии инфекционных осложнений — антибиотики и антимикотики.
Схема лечения и дозировка препаратов зависят от возраста пациента, степени тяжести заболевания и общего состояния здоровья. Эффективность медикаментозной терапии достаточно низкая и непродолжительная. Единственный способ спасти больного — выполнить пересадку костного мозга.
В тяжелых случаях также проводят трансплантацию стволовых клеток.
Несмотря на свою эффективность, эти способы лечения имеют много недостатков: являются дорогостоящими, имеют высокую вероятность отторжения трансплантата, требуют дополнительной подготовки пациента к операции, вызывают трудности в поиске подходящего донора.
В настоящее время развитие генной инженерии и культивирование клеток крови достигли нового уровня. С их помощью процесс кроветворения можно регулировать. Специалисты определяют сколько клеток недовырабатывается индивидуально у каждого больного, а затем переходят непосредственно к лечению.
С помощью любого из вышеперечисленных методов можно добиться полной ремиссии синдрома.
Профилактика
Специфической профилактики синдрома не существует. Профилактические мероприятия, не допускающие ухудшения состояния больных и предупреждающие трансформацию синдрома в лейкоз:
- укрепление иммунитета,
- сбалансированное питание,
- поддержание гемоглобина на оптимальном уровне,
- частые прогулки на свежем воздухе,
- своевременное обращение к врачу при появлении первых признаков синдрома,
- периодическая сдача анализов и прохождение необходимых исследований,
- гигиена кожи,
- защита от контактов с химическими веществами,
- защита от радиации,
- ограничение активной физической нагрузки,
- своевременное лечение простудных и инфекционных заболеваний.
Прогноз
Видео: базовая информация о миелодиспластическом синдроме
Источник: http://sindrom.info/mielodisplasticheskij/
Миелодиспластический синдром
18.10.2017
Миелодиспластический синдром включает ряд злокачественных опухолевых патологий, для которых характерна дисфункция нескольких разновидностей кровяных телец.
Костный мозг, несущий ответственность за синтезирование клеток крови при миелодиспластических синдромах, не может выполнять задачу в полной мере. В итоге организм не получает нужное количество кровеносных телец, развивается анемия.
У человека развиваются такие патологии, как: недостаточность сердца и сосудов, появляется одышка, недомогание. Увеличивается риск инфекционных патологий.
Почему развивается?
Медицинским специалистам не удалось установить причину, из-за которой может развиться миелодиспластический синдром. Врачи установили, что усугубляет развитие группы заболеваний.
https://www.youtube.com/watch?v=KQBTAv4oN5s
Популярным представителем миелодиспластического синдрома считается первичная форма, она встречается в 85% случаев. Среди факторов, которые провоцируют разновидность МДС, стоит выделить такие:
-
- Радиационные частицы оказывают негативное влияние на организм и увеличивают риск миелодиспластического синдрома.
- Любой контакт с токсичными веществами, сюда относятся органические растворители, пестициды и бензин.
- Одним из провоцирующих факторов является курение.
- Заболевания, которые передаются по наследству, увеличивают риск появления миелодиспластического синдрома. К патологиям относится малокровие Фанкони, синдром Дауна и другие.
- Использование в курсе лечения медикаментозных средств, которые ослабляют иммунную систему человека.
- Чем больше возраст, тем выше вероятность миелодиспластического синдрома.
Медицинские специалисты отмечают, что в 15% случаев заболевание имеет вторичный характер.
- Патология получает развитие из-за воздействия химиотерапии при лечении злокачественных опухолей.
- Риск возникновения миелодиспластического синдрома увеличивается под воздействием лекарственных препаратов. К таким относится: Циклофосфан, который останавливает деление не только пораженных тканей, но и оказывает влияние на здоровые клетки человека.
- Ингибиторы, которые катализируют деспирализацию ДНК и препятствуют развитию злокачественной опухоли. К таким препаратам относится: Топотекан.
- Препараты антрациклиновой группы, которые представляют собой лекарственные средства антибактериального и противоопухолевого назначения. Например, Доксорубицин.
- Растительные медикаментозные препараты, которые входят в группу подофиллотоксинов.Главное их назначение – борьба со злокачественными новообразованиями.
Источник: https://telemedicina.one/sosudy/mielodisplasticheskij-sindrom.html
Миелодиспластический синдром
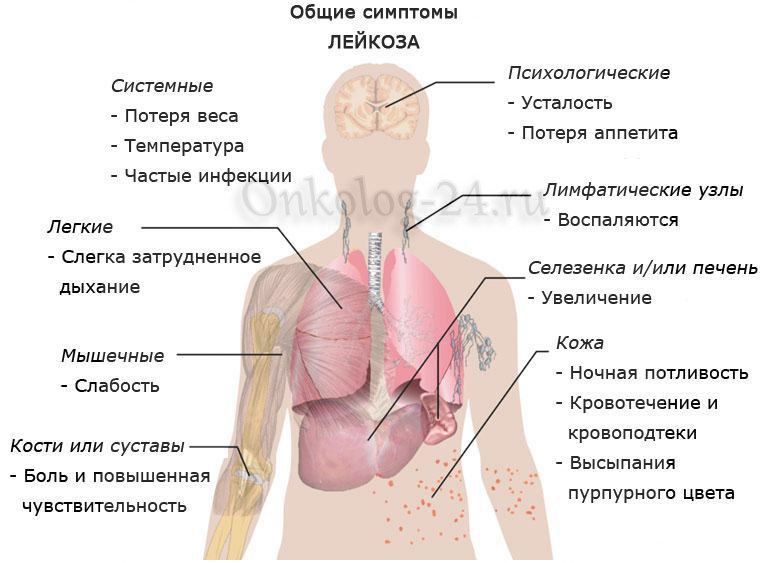
Миелодиспластический синдром (МДС) – группа гематологических заболеваний, обусловленных нарушением работы костного мозга по воспроизведению одного или более типов клеток крови: тромбоцитов, лейкоцитов, эритроцитов.
У людей, страдающих МДС, костный мозг, компенсируя естественный процесс уничтожения клеток крови селезенкой, не в состоянии воспроизвести их в нужном количестве. Это приводит к увеличению риска инфекций, кровоточивости и анемии, которая также проявляется усталостью, одышкой или сердечной недостаточностью.
Развитие МДС может носить как спонтанный характер (без видимых причин), так и быть обусловленным использованием химиопрепаратов, облучения. Последний вариант МДС часто называют «вторичным», и хотя встречается он гораздо реже, хуже поддается лечению.
Подавляющее большинство случае «первичного» МДС развивается у людей старше 60 лет, в детском возрасте болезнь встречается редко.
Клиническая картина МДС
В подавляющем большинстве пациенты обращаются за помощью с жалобами на усталость, утомляемость, одышку при физической нагрузке, головокружения – симптомами, связанными с развитием анемии.
Остальным же пациентам диагноз устанавливается случайно, при лабораторном тестировании анализов крови, сделанных по другим причинам. Реже диагноз устанавливается при лечении инфекции, геморрагического синдрома, тромбоза.
Такие признаки, как потеря веса, немотивированная лихорадка, болевой синдром, также могут быть манифестацией МДС.
Диагноз МДС
Диагностика МДС базируется, прежде всего, на лабораторных данных, которые включают:
- полный клинический анализ крови;
- цитологическое и гистологическое исследования костного мозга;
- цитогенетический анализ периферической крови или костного мозга для выявления хромосомных изменений.
Обязательные диагностические мероприятия при МДС
В обязательный перечень диагностических мероприятий входят:
- Каждому пациенту должно быть проведено морфологическое исследование аспирата, взятого из костного мозга. Это требуется, однако, не является необходимым у пожилых пациентов, у которых установление диагноза МДС не изменяет тактику лечения или тяжесть состояния не позволяет провести исследование. Только на основании морфологического исследования диагноз МДС поставить невозможно – минимальные диагностические критерии не всегда ясны. Трудности возникают, потому что множество реактивных нарушений связано с дисплазией кроветворения, а умеренные диспластические изменения часто отмечаются у здоровых людей с нормальной кровью.
- Каждому пациенту должна быть выполнена трепанобиопсия костного мозга. Гистология костного мозга служит дополнением к уже полученной морфологической информации, следовательно, биопсия должна быть выполнена во всех случаях подозрения на МДС.
- У всех пациентов должен быть выполнен цитогенетический анализ.
Хромосомные нарушения подтверждают присутствие патологического клона и являются определяющими при решении вопроса о наличии МДС или реактивных изменений.
Типы МДС
Классификация МДС основывается на количестве и типе бластных клеток, а также наличии хромосомных изменений, при этом тип МДС у пациента по мере развития заболевания может изменяться в сторону прогрессирования, вплоть до развития острого миелобластного лейкоза у 10% пациентов. Это система классификации используется ВОЗ.
Возможно, самая полезная система клинической классификации для МДС – Международная Прогностическая Система (IPSS). Эта модель была разработана для оценки таких переменных категорий как возраст, тип бластных клеток, генетические изменения. На основании этих критериев было выявлено 4 группы риска – низкий, промежуточный 1, промежуточный 2 и высокого риска.
Рекомендации по лечению основываются именно на отношении пациента к какой-либо из групп риска. Так пациент с низким уровнем риска может жить много лет прежде, чем потребуется лечение МДС, в то время как человек с промежуточным или высоким риском обычно нуждается в немедленном начале лечения.
Классификация МДС
Всемирная организация здравоохранения (ВОЗ), основываясь на уровнях доказательности, издала предложения о новой классификации МДС.
- Рефрактерная анемия (РА)
- Рефрактерная цитопения с мультилинейной дисплазией (РЦМД)
- Миелодиспластический синдром с изолированной del (5q)
- Миелодиспластический синдром неклассифицируемый (МДС-Н)
- Рефрактерная анемия с кольцевидными сидеробластами (РАКС)
- Рефрактерная цитопения с мультилинейной дисплазией и кольцевыми сидеробластами (РЦМД-КС)
- Рефрактерная анемия с избытком бластов-1 (РАИБ-1)
- Рефрактерная анемия с избытком бластов-2 (РАИБ-2)
| Рефрактерная анемия (РА) | Анемия, отсутствие бластов | Дисплазия эритроцитарного ростка, менее 5% бластов, менее 15% кольцевых сидеробластов |
| Рефрактерная цитопения с мультилинейной дисплазией (РЦМД) | Двухростковая цитопения или панцитопения, отсутствие бластов и палочек Ауэра, менее 1х109 моноцитов | Дисплазия более чем 10% клеток в двух и более ростках кроветворения, менее 5% бластов, отсутствие палочек Ауэра, менее 15% кольцевых сидеробластов |
| Миелодиспластический синдром с изолированной del (5q) | Анемия, менее 5% бластов, нормальное количество тромбоцитов | Менее 5% бластов, отсутствие палочек Ауэра, изолированная del (5q) |
| Миелодиспластический синдром неклассифицируемый (МДС-Н) | Цитопения, отсутствие бластов, отсутствие палочек Ауэра | Одноростковая дисплазия гранулоцитарного или мегакариоцитарного ростков, менее 5% бластов, отсутствие палочек Ауэра |
| Рефрактерная анемия с кольцевидными сидеробластами (РАКС) | Анемия, отсутствие бластов | Изолированная дисплазия эритроидного ростка, менее 5% бластов, более 15% кольцевых сидеробластов |
| Рефрактерная цитопения с мультилинейной дисплазией и кольцевыми сидеробластами (РЦМД-КС) | Цитопения (бицитопения или панцитопения), отсутствие бластов и палочек Ауэра, менее 1х109 моноцитов | Дисплазия более чем 10% клеток в двух и более ростках кроветворения, менее 5% бластов, отсутствие палочек Ауэра, более 15% кольцевых сидеробластов |
| Рефрактерная анемия с избытком бластов-1 (РАИБ-1) | Цитопения, менее 5% бластов, отсутствие палочек Ауэра, менее 1х109 моноцитов | Дисплазия одного и более ростков кроветворения, 5-9% бластных клеток |
| Рефрактерная анемия с избытком бластов-2 (РАИБ-2) | Цитопения, 5-19% бластов, возможно наличие палочек Ауэра, менее 1х109 моноцитов | Дисплазия одного и более ростков кроветворения, 10-19% бластов, палочки Ауэра |
Лечение МДС
В настоящее время нет никакого иного способа радикального лечения МДС кроме пересадки костного мозга, хотя существует множество схем для контроля симптомов, осложнений и улучшения качества жизни.
Рекомендации NCCN предлагают, чтобы выбор лечения был основан на возрасте пациента, оценке возможности пациента выполнять нормальные ежедневные задачи и группе риска.
- Высокоинтенсивная терапия требует стационарного лечения и включает интенсивную полихимиотерапию и трансплантацию стволовых клеток.
- Лечение низкой интенсивности включает методы, не требующие длительного стационарного лечения, проводящиеся в амбулаторных условиях или в условиях дневного стационара, – низкодозная химиотерапия, иммунодепрессивная, заместительная терапии.
- Пациенты моложе 61-летнего возраста с минимальными признаками и находящиеся в группе промежуточного риска 2 или высокого риска (ожидаемое выживание 0.3-1.8 года) требуют высокоинтенсивной терапии.
- Пациенты низкой или промежуточной 1 категории (ожидаемое выживание 5-12 лет) лечатся терапией с низкой интенсивностью.
- Пациенты моложе 60-летнего возраста с хорошим статусом и ожидаемым выживанием между 0.4 и 5 годами обычно лечатся схемами низкой интенсивности, хотя могут рассматриваться как кандидаты для высокоинтенсивной терапии, включая трансплантацию.
- Для пациентов с ограниченным сроком жизни рекомендуются поддерживающая и симптоматическая терапии и/или методы лечения низкой интенсивности.
Лечение низкой интенсивности
Поддерживающая терапия является важной частью лечения, и учитывает, как правило, пожилой возраст пациентов, она включает симптоматическую терапию, направленную на поддержание уровня лейкоцитов, тромбоцитов, эритроцитов. Эта терапия призвана улучшить качество жизни и продлить её продолжительность.
- Трансфузия эритроцитарной массы необходима для купирования анемического синдрома. При необходимости неоднократных и массивных трансфузий возникает риск перегрузки железом, что требует использование хелатной терапии.
- Переливание тромбоцитов требуется для профилактики или купирования кровоточивости и, как правило, не ведёт к отдаленным осложнениям.
- Гемопоэтические ростовые факторы – белки, способствующие росту и развитию клеток крови, их использование позволяет сократить потребность в заместительных трансфузиях. Однако много пациентов с МДС не отвечают на ростовые факторы. Гранулоцитарный колониестимулирующий фактор (G-CSF) или гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) могут увеличивать количество нейтрофилов, однако терапия только ими одними не рекомендуется. Рекомбинантный эритропоэтин (EPO, Procrit®, Epogen®) способствует увеличению числа эритроцитов и уменьшает зависимость от гемотрансфузий приблизительно у 20% пациентов с МДС.
Комбинированная химиотерапия, используя G-CSF наряду с EPO, может быть более эффективной, чем использование одного только EPO, особенно у людей из низкой группы риска при пониженном фоновом уровне EPO в сыворотке.
Иммунодепрессивные препараты могут быть эффективны у пациентов с гипопластическим типом кроветворения.
Некоторые из этих пациентов, особенно молодые с ранней стадией болезни и гипоплазией, отвечают на иммунодепрессивные методы лечения, которые противостоят иммунной атаке на костный мозг.
Использование иммунодепрессивной терапии может позволить 50-60% пациентам с HLA DR2 типом ткани прекратить заместительную терапию.
Схемы иммунодепрессивных методов лечения включают антитимоцитарный глобулин (ATG) и циклоспорин.
ATG обычно используется в качестве внутривенной инфузии один раз в день в течение 4 дней, в то время как циклоспорин обычно назначает перорально (приём таблеток) на длительное время, до развития тяжелых осложнений или прогрессирования МДС на фоне лечения. Наиболее частыми осложнениями терапии ATG можно считать сывороточную болезнь, купируемую назначение стероидных гормонов.
Производные талидомида – препарата, стимулирующего иммунную систему и его аналоги (Revlimid®, lenalidomide), – успешно используются в лечении других гемобластозов (лимфомы, множественная миелома).
Lenalidomide особенно эффективен у пациентов с анемией из низкой или промежуточной 1 групп МДС с повреждением 5 хромосомы (синдром 5q минус).
Химиотерапия
Низкие дозы цитостатиков в монорежиме могут быть рекомендованы для людей с промежуточным или высоким риском, которые не являются кандидатами для высокодозной терапии в силу различных причин.
- Цитарабин – наиболее широко изученный препарат, хотя частота достижения полной ремиссии при его использовании ниже 20%.
- Децитабин (Dacogen®) – современный, весьма эффективный препарат, использование которого сопряжено с высоким риском осложнений.
Терапия МДС высокой интенсивности
Пациенты с промежуточным или высоким риском при МДС подлежат терапии режимами химиотерапии аналогично используемым для лечения острого миелобластного лейкоза ОМЛ.
Однако это лечение рекомендуется относительно молодым людям (моложе 60 лет), с хорошим жизненным статусом и при отсутствии HLA-идентичного донора.
Этот тип лечения лучше не применять у лиц старше 60 лет, а также при низком жизненном статусе или большом числе цитогенетических нарушений, так как сопряжен с тяжелыми осложнениями.
У некоторых пациентов поддерживающая терапия может обеспечить тот же результат, что и химиотерапия, но с более низким риском осложнений или токсичности. Некоторые пациенты добиваются большего успеха при проведении только симптоматической терапии осложнений МДС (анемии, инфекции, кровоточивости), не пытаясь излечить саму болезнь.
Как ранее упоминалось, трансплантация стволовых клеток является единственным видом лечения, который может привести к длительной ремиссии. Однако осложнения терапии могут превалировать над возможным эффектом.
В прошлом пациентов старше 50 лет не рассматривали как кандидатов для такого лечения. Достижения последних пятнадцати лет позволили отодвинуть возрастную планку до 60 лет и старше.
Однако приблизительно 75% пациентов с МДС на момент установки диагноза уже старше 60 лет, таким образом, обычная трансплантация может быть предложена только малой части пациентов.
Трансплантация рекомендуется для людей с промежуточным 1, промежуточными 2 и высоким риском моложе 60 лет и наличием идентичного донора, но не для пациентов с низкой группой риска.
Хотя есть существенный шанс на получение ремиссии у пациентов из группы риска (60%), весьма высоки (более 40%) связанные с пересадкой смертельные случаи и частота рецидивирования в течение 5 лет.
Возможно использование неродственных доноров, но в этой ситуации возраст пациента является важным фактором в успехе лечения.
Использование режимов пониженной интенсивности при трансплантации расширяет категории пациентов, которым можно провести это лечение, но долгосрочные результаты еще нуждаются в оценке. Пока создается впечатления о повышенной частоте рецидивов по сравнению со стандартной подготовкой к трансплантации.
Прогноз
У пациентов с МДС средняя продолжительность жизни зависит от категории риска и возраста. Есть значительные вариации течения болезни от пациента к пациенту, особенно в группе низкого риска.
Руководитель отделения гематологии Медицинского центра Банка России, кандидат медицинских наук
Колганов Александр Викторович
Источник: http://www.help-patient.ru/haematology/types/mds/
Миелодиспластический синдром: что это такое, лечение, причины, симптомы

Миелодиспластический синдром относится к тяжелым патологиям системы кроветворения. Несмотря на активное развитие гематологии, лечение его очень сложное и не всегда оказывается эффективным. Прогноз выживаемости для больных зависит от степени тяжести болезни, и радикальные лечебные меры на ранней стадии становится единственным реальным шансом сохранения жизни.
Сущность патологии
Что такое миелодиспластический синдром ( МДС )? Под этим понятием подразумевается целая группа болезней гематологического направления, связанных с нарушениями системы кровотворения миелоидной линии.
Патология характеризуется изменениями костного мозга диспластического типа, наличием цитопении и повышенной вероятностью провоцирования острой формы лейкоза.
Ее суть заключается в том, что, несмотря на продолжение продуцирования зрелых кровяных клеток, в организме обнаруживается нехватка некоторых видов клеток, да и сама клеточная структура претерпевает изменения, что приводит к клеточной неполноценности.
Рассматриваемый синдром не зря иногда называют «дремлющий лейкоз». У больных людей в костном мозге накапливаются бластные клетки, которые и приводят к появлению миелоидного лейкоза у большинства пациентов с указанным диагнозам.
Миелодиспластический синдром чаще проявляется у людей старше 55-60 лет (почти 4/5 всех случаев), более подвержены болезни мужчины. В детском возрасте патология не обнаружена. Однако в последние 10-15 лет намечается определенная тенденция к омоложению среднего возраста больных, специалисты связывают это с экологией крупных городов.
Этиология явления
Этиологический механизм МДС до конца не изучен, но выявлены провоцирующие причины. Исходя из природы патологии, врачами выделяется первичный и вторичный вариант болезни.
Первичный или идиопатический миелодиспластический синдром выявляется у людей старше 62-65 лет, причем причины точно не определяются, но устанавливаются факторы повышенного риска.
К ним относятся: неблагоприятная экология, повышенный уровень радиации, чрезмерное курение, вредные выбросы на производстве, работа с агрессивными веществами (бензин, пестициды, растворители), наследственные патологии (болезнь Дауна, анемия Фанкони, нейрофиброматоз).
Вторичная разновидность заболевания вызывается химиотерапией, лучевой терапией и приемом некоторых сильнодействующих препаратов (Циклофосфан, подофиллотоксины, Доксорубицин, Иринотекан, Топотекан). Этот тип патологии может развиться и в молодом возрасте. Он охватывает примерно 12-18% всех выявленных случаев болезни. Прогноз выживаемости очень неблагоприятный.
Подразделение патологии
В разных странах приняты свои системы классификации МДС, что вызвано разным подходом к лечению. Часто миелодиспластические болезни классифицируются по рекомендациям ВОЗ. Исходя из этого принципа выделяются разновидности патологии:
- Анемия рефрактерного типа. Болезнь характеризуется дисплазией эритроидного ростка костного мозга при отсутствии бластных кровяных клеток. Данная форма анемии может существовать более 6 месяцев.
- Вышеуказанная анемия, но с сидеробластами кольцевого типа.
- Цитопения рефрактерного типа с дисплазией многолинейного характера. Диспластические нарушения обнаруживаются в небольшой части костномозговых клеток (не более 10 процентов). Выявляется небольшое количество бластных клеток (4-6 процентов) в костном мозге, при этом в крови бласты встречаются крайне редко. В анализе крови определяется повышенный уровень моноцитов и панцитопения.
- Анемия рефрактерного типа с высоким уровнем бластов-1. В костном мозге дисплазия охватывает несколько клеточных уровней, а концентрация бластных клеток достигают 7-10 процентов. В крови появляются бласты-1 (до 6 процентов) и большое количество моноцитов.
- То же, но с избытком бластов-2. Общее количество бластных клеток в костном мозге увеличивается до 17-20 процентов, а в крови — до 8-18 процентов. Начинают появляться тельца Ауэра, как в крови, так и в костном мозге.
- Патология , не поддающаяся классификации (МДС-Н). Дисплазия охватывает лишь один росток мегакарио- или гранулоцинарного типа. Бластные клетки в костном мозгу не превышают 4 процентов, в крови отсутствуют. В кровяном анализе наблюдается цитопения.
- Синдром, сочетающийся с 5q-делецией изолированного вида. Фиксируется кровяная анемия, иногда — тромбоцитоз. Бластные клетки превышают 6 процентов и в костном мозгу, и в крови. В костном мозге определяется 5q-делеция.
Симптоматические проявления
Симптомы рассматриваемой болезни зависят от типа патологии и степени ее тяжести.
В целом, они не имеют специфического проявления, во многом похожи на признаки других заболеваний, а потому дифференцировать миелодиспластический синдром достаточно сложно.
Во многих случаях начальная стадия болезни протекает со слабой выраженностью симптомов, поэтому больные не спешат к врачу, что усугубляет последующее осложнение.
Симптоматические проявления связаны с такими процессами:
- Анемия возникает при снижении уровня эритроцитов и гемоглобина. Она наиболее часто встречается при МДС. Основные признаки — бледность кожных покровов, быстрая утомляемость и общая слабость, одышка, головокружение, низкая переносимость физических нагрузок, иногда появляется болевой синдром в грудной области.
- Нейтропения обнаруживается почти у половины больных. Для нее характерно пониженное содержание полноценных, зрелых нейтрофилов. Если данный фактор преобладает в течении болезни, то повышенная температура приобретает стойкий характер. Снижается резистивность организма к инфекционным поражениям, что выражается в учащении заболеваний разного типа (простуды, стоматит, синусит и т.п.).
- Тромбоцитопения возникает при низком уровне тромбоцитов. В таком варианте появляются кровоточивость, что может выражаться кровотечениями десен и носовой полости, учащением кровотечений разного характера и появлением синяков.
- Достаточно часто (почти 25 процентов) патология приводит к увеличению лимфатических узлов, а также расширению печени и селезенки.
Диагностические мероприятия
Диагностика МДС строится на тщательном анализе периферической крови и костного мозга. Проводится общий анализ, цитологические, цитохимические и цитогенетические исследования.
При исследовании крови особое внимание уделяется вычислению количества лейкоцитов, тромбоцитов и ретикулоцитов. Чаще всего у больных выявляется панцитопения, а также цитопения одного или двух ростков.
В более 85 процентах случаев наблюдается анемия, а у 2/3 больных — лейкопения или нейтропения.
Наиболее полную картину болезни дают результаты исследования костного мозга. Образцы его отбираются двумя основными методами — путем биопсии или трепанобиопсии из участка подвзвдошной кости. Исследования проводятся в следующих направлениях:
- Гистология костного мозга дает возможность изучить изменение строения, наличие поражения диффузного или очагового характера, установить наличие аномальных клеток, определить баланс кроветворной и жировой ткани.
- Биохимический анализ оценивает процесс обмена железа, витаминов и фолиевой кислоты.
- Иммунологические пробы и цитогенетические исследования направлены на выявление хромосомных аномалий.
Диагностические исследования должны помочь поставить точный диагноз, и только на его основании может быть начато лечение.
Дифференцировать МДС необходимо от таких патологий, как анемии при дефиците витамина В12, фолиевой кислоты; анемия апластического типа; миелолейкоз и иные острые формы лейкоза; заболевания лимфопролиферического характера. Похожие симптомы могут возникать при отравлениях тяжелыми металлами.
В соответствии с международной классификацией установлены такие минимальные диагностические критерии:
- длительная, устойчивая цитопения продолжительностью не менее 5,5-6,5 месяцев;
- дисплазия, охватывающая более 8 процентов клеток в костном мозге;
- количество бластных клеток в пределах 6-18 процентов;
- появление аномального кариотипа — 5q, 20q или 7q делеции;
- дополнительное условие — обнаружение молекулярных маркеров.
Принципы лечения
При постановке точного диагноза миелодиспластического синдрома и появлении риска лейкоза обеспечивается интенсивное лечение с применением комплексной терапии, химиотерапии, иммуносупрессивных методик. При тяжелом течении болезни осуществляется трансплантация костного мозга.
Наиболее распространена комплексная, сопроводительная терапия. Она базируется на внутривенном введении кровяных ингредиентов. Для исключения избыточного повышения содержания железа при такой процедуре назначаются препараты для связывания железа (хелаторы — Десферал, Эксиджад).
Иммуносупрессорное лечение проводится в присутствии гена HLA-DR15 и костномозговых гипоклеток. Чаще всего вводится препарат Леналидомид. Химиотерапия необходима при высоком риске возникновения острой формы лейкоза; при выявлении такой разновидности МДС, как анемия с большим содержанием бластных клеток; костном мозге гиперклеточного типа. Для обеспечения лечения используется Цитарабин.
Эффективность лечения повышается при назначении гипометилирующих лекарств.
Прогноз выживаемости больных основывается на степени тяжести патологии. С учетом этого показателя выделяется 5 категорий МДС. Наиболее легкая форма позволяет обеспечить эффективное лечение, и продолжительность жизни превышает 12-14 лет. Прогноз жизни в самой тяжелой группе не превышает 9-10 месяцев.
Миелопластический синдром является тяжелой патологией и, как правило, трансформируется в острый лейкоз. Только своевременное выявление и адекватное лечение может обеспечить максимальное продление жизни.
Источник: https://krov.expert/zabolevaniya/mielodisplasticheskij-sindrom.html