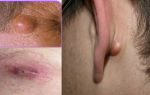
Определение показаний к проведению адъювантной лучевой терапии у больных раком молочной железы с учетом клинико-морфологических факторов прогноза
Симонов К.А., Старцева Ж.А., Слонимская Е.М.
Рак молочной железы (РМЖ) в течение многих лет удерживает первое место в структуре онкологической заболеваемости женского населения России, составляя 20,4%. В связи с неуклонным ростом заболеваемости, проблема лечения больных РМЖ, на сегодняшний день, приобретает особенно большое значение [1].
В соответствии с современными представлениями в лечении данной патологии должен преобладать комплексный подход, важнейшим компонентом которого является лучевая терапия. В качестве метода локального воздействия, послеоперационная лучевая терапия, проводимая у пациенток, перенесших радикальную мастэктомию (РМЭ), снижает риск возникновения местного и регионарного рецидива с 32-35% до 8-9%.
Анализ литературных данных позволяет утверждать, что проведение лучевой терапии в послеоперационном периоде обеспечивает высокие показатели не только безрецидивной, но и общей выживаемости [4,5,10,15,16]. Несмотря на убедительность данных, свидетельствующих об эффективности адъювантной лучевой терапии (АЛТ), остается ряд нерешенных вопросов.
В первую очередь это касается определения категории больных, нуждающихся в проведении АЛТ и выбора объема тканей, подлежащих облучению.
В соответствии с общепринятым подходом, адъювантная лучевая терапия после РМЭ однозначно показана больным с размером первичного опухолевого очага от 5 см и выше, а также с наличием четырех и более метастатических аксиллярных лимфатических узлов, подтвержденных результатами морфологического исследования [7,9,19].
Спорным остается вопрос, касающийся целесообразности проведения АЛТ больным при опухолях меньшего размера и наличии от одного до трех лимфоузлов, пораженных метастазами (N1). Стандартное назначение АЛТ для этой категории пациенток считается не оправданным ввиду достаточно низкой частоты локо – регионарного рецидивирования [8,17,18,19].
В этой связи, в последнее время большое внимание уделяется дифференцированному подходу к лучевой терапии, основанному на клинико–морфологических и молекулярно – генетических факторах, определяющих высокий риск развития локо – регионарного рецидива РМЖ.
В настоящее время в зарубежной литературе представлены данные, в которых, при определении показаний к проведению лучевой терапии, подчеркивается необходимость учета таких прогностически неблагоприятных факторов, как молодой возраст больных (до 35 лет), состояние сохраненной менструальной функции, размер первичной опухоли, II-III степень дифференцировки новообразования, наличие опухолевых клеток по краю кожных лоскутов после выполнения РМЭ, количество лимфатических узлов, пораженных метастазами, прорастание опухолью капсулы лимфоузла, наличие лимфоваскулярной инвазии, отсутствие рецепторов к эстрогену и к прогестерону [2, 14, 18, 20].
Дискутабельным остается вопрос, касающийся определения объема тканей, подлежащих облучению. Известно, что после выполнения РМЭ область передней грудной стенки является зоной высокого риска в отношении развития местных рецидивов опухоли.
Поэтому при наличии таких показаний, как размер первичного очага более 5 см, прорастание опухолью фасции большой грудной мышцы иили наличие опухолевых клеток по краю кожных лоскутов после выполнения РМЭ, передняя грудная стенка должна быть включена в объем облучения [7,9,19].
В случае же небольшой распространенности опухолевого процесса, требуется индивидуальный подход к выбору объема лучевой терапии, с учетом дополнительных неблагоприятных факторов риска [11,12].
Единой же точки зрения в интерпретации и практическом использовании вышеуказанных признаков при определении показаний к назначению АЛТ нет.
Еще одним неоднозначным вопросом является определение зон регионарного лимфооттока, на которые должно быть проведено лучевое воздействие.
Традиционно, метастатическое поражение 4 и более аксиллярных лимфоузлов (N2-3), подтвержденных морфологическим исследованием, является показанием для адъювантной лучевой терапии на все зоны лимфооттока: подмышечную, парастернальную и над-подключичную области.
В случае регионарной распространенности опухоли N1, однозначной точки зрения нет. Ряд авторов полагает оправданным проведение лучевой терапии на все зоны лимфооттока при наличии метастатических лимфоузлов, независимо от их количества (от 1 до 3) [13,16].
Однако большинство специалистов в области лучевой терапии считают такой вариант лечения не целесообразным ввиду высокой вероятности осложнений после облучения [3,6]. Поэтому не теряет своей актуальности индивидуальный подход к выбору показаний и объема АЛТ у больных РМЖ, основанный на учете прогностических факторов.
Целью настоящего исследования явился сравнительный анализ результатов комплексного лечения больных РМЖ после радикальной мастэктомии с применением различного объема адъювантной лучевой терапии и определение показаний к АЛТ с учетом клинико–морфологических факторов прогноза.
Материалы и методы. В исследование были включены 115 пациенток с операбельным раком молочной железы T1-3N0-3M0, получавших комплексное лечение в отделениях общей онкологии и радиологии ФГБУ «НИИ онкологии» СО РАМН. Возраст больных варьировал от 28 до 76 лет, средний составил 53,8±1,8 лет.
В плане комплексного лечения пациентки получали 2-4 курса неоадъювантной химиотерапии по схемам: CMF, FAC; хирургическое вмешательство проводилось в объеме радикальной мастэктомии; адъювантная химиотерапия по вышеуказанным схемам, а при наличии положительного рецепторного статуса – антиэстрогенная терапия в течение 5 лет. Всем больным была проведена послеоперационная дистанционная лучевая терапия.
В зависимости от применяемого объема и вида адъювантной лучевой терапии больные были распределены на две группы.
В I группе (n-55, исторический контроль) пациенткам проводилась дистанционная лучевая терапия (ДЛТ) только на зоны регионарного лимфоотока в стандартном режиме фракционирования: разовая очаговая доза (РОД) – 2,0 Гр, 5 раз в неделю, суммарная очаговая доза (СОД) – 40-44 Гр.
Во II группе (n-60) курс лучевой терапии включал в себя помимо облучения зон лимфооттока проведение электронной терапии на область послеоперационного рубца на малогабаритном бетатроне 7-10 МэВ в режиме: РОД-3,0 Гр, 5 фракций в неделю, СОД-38-44 изоГр.
Изучаемые группы больных были репрезентативны по распространенности опухолевого процесса.
Методика лучевой терапии.
Лучевая терапия быстрыми электронами проводилась на область послеоперационного рубца, на малогабаритном бетатроне с энергией 7-10 МэВ, при этом 80% изодоза располагалась на глубине 2-2,5 см от поверхности поля облучения.
Размеры полей облучения на послеоперационный рубец (в проекции ложа удаленной опухоли), составляли 6х6-6х18 см2. Режим фракционирования дозы быстрых электронов: РОД – 3,0 Гр, 5 фракций в неделю, СОД 38-44 изоГр [2].
Проведение ДЛТ на зоны регионарного лимфооттока осуществлялось на аппаратах «Рокус-М», линейном ускорителе Siemens SL 75 6 МэВ, в стандартном режиме фракционирования дозы, СОД – 40-44 Гр, с прямых полей облучения, размеры составили:
10х8 см – для над-подключичной области, 6х6-6х8 см – для аксиллярной зоны, 5х12-6х12 см – для парастернальной зоны
Оценка лучевых изменений нормальных тканей проводилась по шкале RTOG/EORTC (1995).
Статистическая оценка результатов проводилась с помощью пакета программ «Statistica 6.0». Для межгруппового сравнения использовались непараметрические критерии. Показатели выживаемости больных рассчитывались по методу Kaplan-Meier. Многомерный анализ данных для построения прогностической модели данных проводился в программе SPSS v17.0.
В качестве метода анализа данных была выбрана логистическая регрессия. Получение прогностической модели проводилось итерационным способом, до тех пор, пока в итоговой модели не остаются только статистически значимые коэффициенты регрессии.
Экспонента от коэффициента регрессии интерпретировалась как значения относительных рисков для соответствующих показателей.
Результаты и обсуждение.
Анализ отдаленных результатов лечения показал, что за 5-летний период наблюдения местные рецидивы РМЖ значительно реже выявлялись у больных, получивших курс АЛТ не только на зоны регионарного лимфооттока, но и на область послеоперационного рубца – в 6,6%, в то время как у пациенток I группы этот показатель был практически в 3 раза выше и составил – 18,1% (p
Источник: http://vrach-aspirant.ru/articles/oncology/13344/
Таксотер в адъювантной и неоадъювантной терапии рака молочной железы: итоги клинических исследований
В России рак молочной железы (РМЖ) занимает 1 место в структуре заболеваемости и смертности от злокачественных новообразований у женщин. Число заболевших увеличилось с 31,9 тыс. (1991 г.) до 45,8 тыс. (2002 г.), 5-летняя выживаемость в Москве и Санкт-Петербурге составляет 59,6-59,3%, а среди вновь выявленных больных около 35% имеют III-IV стадию.
Рисунок 1. Дизайн исследования TAX 301
Таблица 1. Результаты исследования TAX 301 (пациентки, завершившие запланированное лечение) (5, 33)
Рисунок 2. Дизайн исследования NSABP B-27
Таблица 2. Результаты исследования NSABP B-27
Таблица 3. Результаты исследования GEPAR-duo
Рисунок 3. Предоперационная ХТ первично-операбельного РМЖ: дизайн исследования GERPARTRIO
Таблица 4. Результаты исследования BCIRG 001
Таблица 5. Результаты исследования GEICAM 9805
Таблица 6. Результаты исследования USON 9735
Рисунок 4. Преимущества режима ТС по сравнению с АС по подгруппам больных (USON 9735)
Таблица 7. Результаты исследования PACS 01
Таблица 8. Результаты исследования NSABP B-30
Рисунок 5. Дизайн исследования BCIRG 006
Рисунок 6. Результаты исследования BCIRG 006.
Рисунок 7. Дизайн исследования ECOG 1199
Таблица 9. Результаты исследования ECOG 1199
К моменту установления диагноза заболевание, как правило, уже носит системный характер за счет ранней гематогенной диссеминации и наличия микрометастазов.
В большинстве случаев даже раннего РМЖ проведение одного оперативного лечения является недостаточным и требует дополнительной системной лекарственной (химио- и/или гормоно-) терапии, которая может быть предоперационной (неоадъювантной или индукционной) и адъювантной.
Предоперационная химиотерапия проводится как при первично-операбельном РМЖ (неоадъювантная ХТ), так и при местнораспространенном РМЖ (индукционная ХТ). Предоперационная ХТ более эффективна при: высокой степени злокачественности; отрицательных рецепторах стероидных гормонов; высокой пролиферативной активности опухоли (1).
Основной задачей неоадъювантной ХТ первично-операбельного РМЖ является увеличение частоты выполнения органосохранных операций. К дополнительным задачам относится воздействие на микрометастазы и оценка чувствительности опухоли к проводимому лечению (степень лечебного патоморфоза).
Неоадъювантная ХТ операбельного РМЖ сопоставима по эффективности с адъювантной: показатели общей и безрецидивной выживаемости одинаковы, однако при достижении полной патоморфологической регрессии опухоли (рCR или 4 степень лечебного патоморфоза) выживаемость достоверно увеличивается (2, 3).
Не показано проведение неоадъювантной ХТ, если не планируется изменение характера локального лечения (сохранная операция), или если необходимость проведения системной ХТ сомнительна (малые размеры опухоли, N0, наличие сопутствующей патологии в пожилом возрасте, высокий уровень рецепторов стероидных гормонов в опухоли).
В целом стандартом лечения больных операбельным РМЖ на сегодняшний день остается адъювантная системная (химио- и/или гормоно-) терапия (4).
Основной задачей индукционной ХТ местнораспространенного (условно-операбельного – IIIа стадия и неоперабельного – IIIb, IIIc стадии) РМЖ является уменьшение объема поражения и выполнение радикального оперативного вмешательства, а основной целью – излечение, которое, в отличие от диссеминированного РМЖ, считается возможным. Общая тактика проведения индукционной ХТ соответствует таковой при неоадъювантной ХТ, при отсутствии эффекта от первой линии лечения переходят на вторую.
Таксотер (доцетаксел) был одобрен для применения при метастатическом раке молочной железы (РМЖ) в 1996 г., а первое большое клиническое исследование по этому показанию началось в 1993 г. С этого момента около 59 000 пациенток было включено в 77 исследований III фазы, изучающих Таксотер при РМЖ.
В результате полученных фундаментальных данных препарат прочно занял место в ряду основных высокоактивных лекарственных агентов, используемых для терапии данного заболевания, и более 1 500 000 больных РМЖ за это время получили Таксотер в рутинной практике.
В представленном обзоре рассмотрен ряд важных клинических исследований по применению Таксотера в неоадъювантной и адъювантной терапии РМЖ. Периодический анализ и переосмысление полученных данных имеют большое значение для ежедневной деятельности онкологов, а также задают стандарты лечения РМЖ в будущем.
Необходимо заметить, что все приведенные далее результаты получены при изучении оригинального препарата и не могут быть напрямую экстраполированы на его дженерики или другие таксаны. Именно поэтому в статье используется оригинальное название лекарства – Таксотер®.
Таксотер в неоадъювантной терапии РМЖ
Эффективность Таксотера в неоадъювантной терапии РМЖ изучена в целом ряде исследований. В одно из первых – Абердинское – включены 162 больных с впервые установленным диагнозом, опухолями Т2 более 3 см или местнораспространенной формой заболевания (Т3, Т4, ТхN2) без отдаленных метастазов.
На первом этапе всем проведено 4 цикла стандартной антрациклинсодержащей ХТ (использована схема CVAP: циклофосфан, винкристин, доксорубицин, преднизолон). На втором этапе 55 пациенток, не ответивших на начальную терапию, получали 4 курса Таксотера (рисунок 1).
Пациентки, ответившие на терапию (n = 104), были рандомизированы на две группы: в первой продолжали химиотерапию по схеме CVAP (еще 4 курса), вторую переводили на Таксотер (4 курса по 100 мг/м2 1 раз в 3 нед.), после чего всем больным выполнялась радикальная операция.
Основной целью исследования было сравнение эффективности Таксотера с антрациклинсодержащим режимом.
В группе пациенток, ответивших на начальную химиотерапию по схеме CVAP, общая эффективность лечения, а также частота полных морфологически подтвержденных ответов (pCR) была достоверно выше у больных, переведенных на Таксотер, по сравнению с продолжением терапии CVAP. Кроме того, Таксотер ассоциировался с достоверным улучшением не только безрецидивной, но и общей выживаемости и увеличением частоты выполнения органосохранных операций (таблица 1).
В группе пациенток, не ответивших на антрациклинсодержащую ХТ, перевод на Таксотер позволил добиться 55% полных и частичных регрессий и 2% полных патоморфологически подтвержденных ответов (5).
Кроме того, частота нейтропении 3-4 степени была достоверно ниже у больных, получавших лечение с включением Таксотера (4 курса CVAP→4 Таксотера) по сравнению с 8 курсами CVAP (60% и 69% соответственно, р = 0,006).
Оптимальная стратегия периоперационного применения Таксотера при первично-операбельном РМЖ (T1c-3N0-1M0) была оценена в исследовании NSABP B-27, включавшем 2411 пациенток, которые были рандомизированы на 3 группы (рисунок 2).
На первом этапе все больные получили 4 курса химиотерапии по схеме АС. Затем первая группа оперировалась без последующего адъювантного лечения; вторая группа получала еще 4 курса неоадъювантной терапии Таксотером по 100 мг/м2 1 раз в 3 нед.
и затем оперировалась; третья группа подвергалась оперативному лечению после 4 курсов АС, но получала 4 курса Таксотера адъювантно.
Всем больным с гормоночувствительными опухолями с первого дня назначали тамоксифен по 20 мг в день, после органосохранных операций проводили лучевую терапию. Основной целью была оценка общей и безрецидивной выживаемости.
Показано, что включение Таксотера в режим неоадъювантной химиотерапии приводит к достоверному увеличению в два раза частоты полных патоморфологически подтвержденных регрессий (таблица 2), к увеличению клинически зарегистрированных полных эффектов с 40 до 64% (p < 0,001) и к уменьшению частоты выявления метастазов в регионарных лимфоузлах с 58,2 до 50,8% (p
- КЛЮЧЕВЫЕ СЛОВА: рак молочной железы, онкология, новообразования, патоморфоз, Таксотер
Источник: http://umedp.ru/articles/taksoter_v_adyuvantnoy_i_neoadyuvantnoy_terapii_raka_molochnoy_zhelezy_itogi_klinicheskikh_issledova.html
Адъювантная гормональная терапия
Госпиталь Ихилов / РАК ГРУДИ / Адъювантная гормональная терапия
Адъювантная гормональная терапия – это такое лечение, которое проводится после основного, и целью которого является снижение риска рецидива рака.
При ранних стадиях рака молочной железы гормональная терапия обычно следует после других форм лечения, таких как операция, химиотерапия и облучение радиацией.
Такая гормональная терапия длится в среднем от 5 до 10 лет. Чаще всего, если гормональная терапия проводится в виде адъювантной терапии, врач назначит Вам тамоксифен либо один из препаратов ингибиторов ароматазы на 5 лет.
Если Вы принимали тамоксифен в течение двух – трех лет и у Вас наступила менопауза, то Вас переведут на ингибиторы ароматазы на оставшееся срок гормональной терапии.
Если же Вы полностью прошли курс гормональной терапии тамоксифеном в течение пяти лет, и теперь наступила менопауза, то обычно рекомендуется еще в течение пяти лет принимать фемару.
Если пациентка принимала в течение пяти лет ингибиторы ароматазы, вопрос о дальнейшей тактике гормональной терапии пока что остается еще под вопросом.
Продленный курс адьювантной гормонотерапии
Если у Вас метастатическое распространение рака молочной железы и Вы перешли с тамоксифена на ингибиторы ароматазы, то рекомендуется принимать их до тех пор, пока сохраняется их эффект. Смена гормонального препарата проводится так же и в том случае, когда во время приема определенного препарата возникает рецидив рака и его распространение.
Например, Вас могут перевести на другой препарат группы ингибиторов ароматазы либо на фаслодекс. Более того, если ингибиторы ароматазы уже неэффективны в контроле роста опухоли, эффект может дать прием тамоксифена (только если Вы раньше не прекратили прием тамоксифена по причине его неэффективности).
Продленный курс адъювантной терапии означает прием гормональных препаратов после окончания курса адъювантной терапии. К примеру, после пятилетнего курса тамоксифена врачи рекомендуют пройти курс ингибиторов ароматазы так же в течение пяти лет, в частности – фемары.
В пользу применения препарата свидетельствуют результаты исследования МА-17, которые показали, что Фемара снижает риск возникновения рецидива после окончания стандартного курса лечения тамоксифеном в течение 5 лет. Фемара стала первым препаратом, чье преимущество применения по этим показаниям доказано.
В данном исследовании участвовало более 5000 пациенток с раком молочной железы. Половина пациенток принимало в течение пяти лет фемару, другая же половина – плацебо (препарат-пустышку). До начала исследования все эти женщины прошли курс тамоксифена в течение 4,5 – 6 лет после первичного лечения.
Результаты исследования показали, что фемара способна сократить риск рецидива опухоли почти в два раза по сравнению с плацебо. Исследование было прекращено ранее, чем предполагалось, так как это позволили его результаты, и все пациентки далее принимали фемару.
Источник: https://ichilov.net/breastcancer/Adjuvanthormonaltherapy/
Адъювантная химиотерапия – дополнительный метод борьбы с раком
Адъювантная химиотерапия – это использование мощных ядов цитостатического действия, направленного на уничтожение раковых клеток. Она назначается, чтобы предотвратить развитие раковых клеток, которые могли остаться после операции.
Адъювантная химиотерапия – общие сведения
Влияние адъювантной химиотерапии осуществляется на уровне ДНК, когда молекулы применяемых препаратов внедряются в цепь нуклидов, тем самым разрывая ее.
Клетка под таким воздействием уже не в состоянии делиться, и выпадает из синтеза ДНК. Цитостатики, назначаемые при адъювантной химиотерапии, имеют различную основу – растительную (Винкристин) и из алкилующих агентов (Циклофосфамид). Кроме этого используют различные антибиотики, антрациклины и платиновые препараты (например, Адриамицин и Рубоминицин).
Для проведения дополнительной (или адъювантной) терапии официального подтверждения наличия метастаз после операции не требуется – это учитывается априори. Именно предполагаемая вероятность скрытых опухолевых процессов является основанием для назначения химиотерапии, на которую пациент либо соглашается, либо отказывается от нее из-за сильных побочных действий.
Адъювантная химиотерапия – это уничтожение раковых клеток с помощью ядов цитостатического действия.
Основные показания
Среди основных показаний для проведения дополнительной послеоперационной терапии выделяются следующие:
- рак яичников, матки, молочных желез у женщин;
- хорионкарцинома мужских половых органов;
- опухоли в легких;
- разрушение мышечных тканей (рабдомиосаркома);
- нефробластома (или опухоль Вильмса и Беркитта), встречающаяся обычно у детей.
Применяется адъювантная химиотерапия и при лейкозах, проявляющихся поражением системы кроветворения. В данном случае лечение с помощью химических препаратов является основным методом, так как при этом диагнозе проводить операцию нереально.
Но при явной необходимости применения адъювантной химиотерапии, в ряде случаев использовать ядовитые химпрепараты невозможно из-за имеющихся противопоказаний.
Противопоказания:
- при достаточно серьезных заболеваниях печени и почек;
- при камнях в желчном пузыре;
- при болезнях сердечнососудистой системы;
- при проблемах в легких;
- при изменениях, обнаруженных в общем анализе крови (гематокрите, низком гемоглобине и небольшом количестве тромбоцитов).
Под запрет для проведения послеоперационной химиотерапии попадают больные, чья масса тела не превышает 40 кг.
Особенности введения
Цитостатики выпускаются в различных формах, но таблетированные препараты и мази не дают нужного эффекта. Поэтому введение ядовитых лекарств чаще всего проводится иными методами:
- основной способ введения препаратов – посредством капельниц внутривенно;
- иногда уколами через артерии;
- редко – инъекциями в брюшную полость.
Способ введения препаратов – посредством капельниц внутривенно.
Оптимальные сроки начала адъювантной химиотерапии – в ближайшие дни после операции. Далее процедуры проводятся несколькими курсами, так как одного будет недостаточно (здесь учитывается цикличность развития раковых опухолей).
Обычно введение препаратов назначают по такой схеме: 3 сеанса ежедневно, затем перерыв на 2, 3 или 4 недели (в зависимости от степени болезни и диагноза). И так продолжается от 3 до 6 (иногда и более) месяцев.
Длительные курсы химиотерапии связаны с тем, что не все клетки в организме делятся одновременно – какие-то из них находятся в спячке, и воздействию ядовитых препаратов в такой момент не подвержены. Раковым клеткам необходимо дать возможность проснуться и стать задействованными в синтезе ДНК. В период деления они наиболее податливы для проникновения в цепочку действующего лекарства.
На момент проведения терапии больной должен находиться под постоянным наблюдением врача, поэтому приходится ложиться периодически на стационар. В перерывах между сеансами приводится контроль крови, который покажет, насколько эффективной была предпринятая попытка остановить развитие метастаз.
Эффективность адъювантной химиотерапии
Введение химических препаратов после операции в общей сложности дает хороший результат, замедляя разрастание опухоли (а иногда и полностью ее останавливая). Но не каждый тип онкологии поддается дополнительному лечению:
- при раке желудка цитостатики не всегда действуют эффективно; более отзывчив на терапию диагноз «аденокарционома»;
- хорошо поддается лечению данными препаратами рак легких; в некоторых случаях адъювантная терапия назначается, даже если не было проведено операбельное вмешательство – при диффузной мелкоклеточной опухоли; а вот 4-ая стадия онкологии легких уже не поддается цитостаткикам; не назначают препараты и при декомпенсированных болезнях легких;
- при раке груди химиотерапия способна остановить метастазы на отдельных участках (с вовлечением лимфоузлов); при мелких очагах (менее 1 см) цитостатики не назначаются.
Несмотря на то, что химиотерапия оказывает сильное блокирующее действие на раковые клетки, некоторые пациенты от нее отказываются из-за серьезных побочных эффектов. Химиопрепараты нарушают работу многих систем в организме и вместе с больными клетками затрагивают здоровые.
Осложнения связаны с особенностью самих препаратов действовать разрушительно на ткани и органы. Циклическое деление опухолевых клеток проходит быстрее, чем у здоровых, и это учитывается при воздействии на них лекарственных препаратов.
И если опухолевые клетки просто уничтожаются, то здоровые ткани начинают разрушаться, приводя к серьезным сбоям в здоровых органах. Все это провоцирует значительные негативные явления в системах человека.
Негативное влияние цитостатиков:
- наблюдается разрушительное действие на печень, почки, ЖКТ, сердце;
- атрофируются мышцы, болят суставы и кости;
- видоизменяются кровеносные сосуды;
- больной часто мучается сильной тошнотой, рвотой, диареей;
- угнетается процесс кроветворения, из-за чего резко падает иммунитет.
У человека не просто наблюдается упадок сил – весь организм становится незащищенным перед инфекциями, и малейшая из них спровоцирует сильные осложнения. Проявляется негатив и внешне – у больных резко выпадают волосы, а кожа становится чересчур бледной (почти прозрачной).
Химиопрепараты нарушают работу многих систем в организме и вместе с больными клетками затрагивают здоровые.
Используемые во время дополнительной химиотерапии препараты оказывают и нейротоксическое действие на пациентов. У них нарушается сон, они страдают плаксивостью и подвержены глубоким депрессиям.
В тех случаях, когда не реально излечиться от рака оперативным путем, больным назначают ПХТ – паллеативную химиотерапию, которая проводится немного иначе, чем адъювантная, но при ней также используются цитостатики. Проводится пхт постоянно, независимо от сроков болезни, и может длиться годами.
Пациент после процедур чувствует себя относительно хорошо. Но сама аббревиатура – это приговор для больного, так как данная терапия нацелена не столько на уничтожение опухоли, сколько на поддержание жизни человека.
Источник: https://oonkologii.ru/adyuvantnaya-himioterapiya/
Лечение первично операбельного рака молочной железы
Под первично операбельным РМЖ понимается такая степень распространенности рака, при которой на момент диагностики возможно выполнение операции, дающей стойкий местно-регионарный контроль болезни [1]. Критерии иноперабельности, предложенные C. Haagensen и A. Stout в 1943 г.
, относятся к клинической симптоматике местно-распространённого рака IIIb и IIIc стадий [2].
Случаи местно-распространенного РМЖ, относящиеся к IIIa стадии, формально являются первично операбельными, хотя по своим биологическим характеристикам их операбельность условна, для этой категории пациентов тактика с предоперационной терапией обеспечивает лучшие отдаленные результаты [3, 4]. Таким образом, под первично операбельным РМЖ мы понимаем рак I-II стадий.
Обычной тактикой лечения первично операбельного РМЖ является выполнение операции на первом этапе с последующими мерами адъювантной терапии: химиотерапии, лучевой терапии, гормонотерапии.
Альтернативной тактикой является проведение системной терапии на первом этапе с выполнением операции на втором этапе.
Проведение системной терапии при первично операбельном раке (неоадъювантная терапия) не дает преимуществ в отдаленных результатах, но позволяет выполнить органосохраняющие операции большему количеству больных [5, 6, 7].
Итак, первое преимущество неоадъювантной системной терапии состоит в повышении частоты выполнения органосохраняющих операций у больных с относительно крупными опухолями.
Нужно иметь в виду, что это преимущество теряется в случаях, когда у больных, помимо большого размера опухоли имеются другие противопоказания к органосохраняющим операциям (мультицентричность опухоли, внутриорганные метастазы, распространенный внутрипротоковый компонент, противопоказания к лучевой терапии).
Второе преимущество состоит в возможности клинически и морфологически оценить чувствительность данной опухоли к конкретному варианту системной терапии и, исходя из этого, модифицировать адъювантную терапию.
Основным показанием к проведению неоадъювантной терапии является большой размер опухоли, не позволяющий выполнить органосохраняющую операцию с приемлемым эстетическим результатом, и желание больной избежать мастэктомии.
Вместе с тем следует помнить и о возможных неудачах неоадъювантной терапии (и информировать об этом пациентку), в случае прогрессирования опухоли на фоне неоадъювантной терапии может быть упущена возможность выполнения любой операции.
Конкретные варианты неоадъювантной терапии будут рассмотрены в главе «Лечение местно-распространенного рака молочной железы». Вопросы адъювантной лучевой терапии и техника операций представлены в соответствующих главах.
Адъювантная системная терапия
Адъювантная терапия проводится у больных после радикальных операций, является профилактическим лечением.
Показания к ее проведению основываются на историческом опыте, расчетных данных, характеризующих закономерности течения болезни в группах больных со сходными исходными характеристиками.
Основные вопросы, подлежащие решению при планировании адъювантной терапии, это оценка риска рецидива болезни и выбор средств, имеющих наибольший профилактический эффект.
Адъювантная гормонотерапия
Удаление яичников или подавление их функции. Из методов адъювантной терапии первым стали изучать удаление яичников или лучевое подавление их функции.
Ранние исследования с рандомизацией относительно небольшого количества больных РМЖ различных стадий констатировали отсутствие улучшения отдаленных результатов в опытной группе [8-10].
Эффективность этой процедуры проявилась в значительно более поздние сроки и стала очевидной при мета-анализе объединенных массивов больных, первые группы которых лечились в 1948-1950 гг. [11-13].
Была показана эффективность удаления яичников или подавления их функции у больных в возрасте до 50 лет, как с поражением лимфатических узлов, так и без него.
В группе пациенток, не получавших адъювантной химиотерапии, снижение риска рецидива болезни от удаления яичников составило 25-29% (2р = 0,0005), а снижение риска смерти – 29% (2р = 0,0006) по сравнению с группой больных, не получавших никакой адъювантной системной терапии (число больных 1 711 и 1 683 соответственно). У больных с проведением адъювантной химиотерапии достоверных различий БРВ и ОВ в зависимости от удаления яичников или подавления их функции не было обнаружено (в группах сравнения 2 139 и 2 192 больных).
Применение агониста LHRH (гозерелин) позволяет добиться подавления функции яичников на период введения препарата. Затем функция яичников может восстановиться так же, как и фертильность. Как было показано в рандомизированном исследовании C.W. Taylor et al. [14] у больных диссеминированным РМЖ применение гозерелина столь же эффективно, как и овариэктомия.
Итальянская группа по исследованию адъювантной терапии РМЖ [15] представила результаты изучения эффективности сочетания подавления функции яичников (преимущественно с помощью гозерелина) и 5-летнего лечения тамоксифеном.
Группу сравнения составили пациентки, получавшие химиотерапию по схеме CMF. Все больные были в пре- или перименопаузе и имели рецептор-позитивные опухоли. Отдаленные результаты лечения были одинаковы. M. Kaufmann et al.
[16] сравнивали эффективность адъювантной терапии у больных с поражением лимфатических узлов. Рандомизация проводилась между химиотерапией по схеме CMF и гормонотерапией гозерелином. У пациенток с опухолями РЭ+ получены эквивалентные БРВ и ОВ в сравниваемых группах.
В случаях опухолей РЭ- химиотерапия имела статистически значимые преимущества по БРВ и ОВ.
Противопоставление гормонотерапии и химиотерапии, возможно, интересно с теоретической точки зрения, однако более важно уточнить, можно ли получить суммацию эффекта от 2 видов лечения. Такую цель преследовало VIII исследование Международной группы по исследованию РМЖ [17].
Больных репродуктивного периода (n = 1063) с отсутствием метастатического поражения лимфатических узлов разделялись слепым методом на лечение гозерелином в течение 24 мес., либо на химиотерапию по схеме CMF (6 курсов), либо на последовательное применение химиотерапии по схеме CMF и гормонотерапии гозерелином в течение 18 мес.
Средняя длительность наблюдений равна 7 годам. У больных с РЭ- опухолями при лечении только гозерелином 5-летняя БРВ была статистически значимо ниже (73%), чем в группах, где применялись CMF (84%) или CMF + гозерелин (88%).
Среди пациенток с опухолями РЭ+ как химиотерапия, так и гормонотерапия гозерелином имели равный эффект (5-летняя БРВ в обеих группах по 81%), по отношению к этим результатам последовательная терапия по схеме CMF+гозерелин не давала статистически значимого преимущества (5-летняя БРВ 86%).
В исследование ZIPP (Zoladex In Premenopausal Patients) было включено 2 706 больных первично операбельным РМЖ.
После проведения первичного лечения (операция ± лучевая терапия ± химиотерапия) больным слепым методом выбирали дальнейшее лечение: 1) гозерелин на 2 года; 2) тамоксифен на 2 года; 3) сочетание этих препаратов; 4) отсутствие терапии. Применение гозерелина снижало вероятность рецидива болезни на 13,9 % и смерти от РМЖ на 8,5% по сравнению с больными, не получавшими гормонотерапию.
Добавление гозерелина к тамоксифену не сопровождалось статистически значимым снижением вероятности рецидива болезни и вероятности смерти от РМЖ по сравнению с применением только тамоксифена [18, 19].
Объединенной группой по исследованию адъювантной терапии рака молочной железы (The Adjuvant Breast Cancer Trials Collaborative Group [20]) проведено рандомизированное сравнение, позволяющее оценить влияние подавления функции яичников на отдаленные результаты лечения РМЖ. Больные первично операбельным РМЖ (T1-3N0-1M0) — 2 144 чел.
— после операции получали химиотерапию (78% больных) и лучевую терапию по принципам, исповедуемым в каждом из медицинских центров, участвующих в исследовании.
Все больные длительно получали тамоксифен, рандомизировалось отсутствие воздействия на яичники или подавление их функции (в 69% — лучевое, в 23 — хирургическое удаление и в 8% — агонистами LH-RH в течение 2 лет).
Как при сравнении общих групп, так и при сравнении во всех анализируемых подгруппах, не наблюдалось статистически значимых различий по показателям ОВ и БРВ. Тенденция к улучшению результатов лечения от подавления функции яичников наблюдалась в небольшой подгруппе женщин до 40 лет, не получавших адъювантной химиотерапии.
Итак, в 3 последних исследованиях воспроизведен вывод, известный по мета-анализу Early Breast Cancer Trialists’ Collaborative Group [11, 12, 13]: у больных, получающих адъювантную химиотерапию и/или тамоксифен, целесообразность выключения функции яичников является не доказанной.
На практике эта процедура оказывается лишней.
Поэтому в рекомендациях конференций по адъювантной терапии РМЖ в Сан-Галлене, в рекомендациях различных онкологических обществ и организаций предложение по подавлению функции яичников у больных, получающих химиотерапию или тамоксифен, включено со знаком «±».
Побочные эффекты выключения функции яичников – это все проявления посткастрационного синдрома (из них самый частый симптом – «приливы», наблюдается в 26-44% [18] и остеопороз [21]. У больных в возрасте до 40 лет в большинстве случаев на протяжении полугода после завершения приема агонистов LH-RH восстанавливается овариально-менструальный цикл и уходят побочные эффекты [22].
Таким образом, выключение функции яичников в самостоятельном варианте является эффективным методом адъювантной гормонотерапии.
Сочетание адъювантной химиотерапии с выключением функции яичников не превышает эффективности одной химиотерапии, сочетание адъювантной гормонотерапии тамоксифеном с выключением функции яичников не превышает эффективности одной гормонотерапии тамоксифеном.
В этих случаях выключение функции яичников является избыточным воздействием, не имеющим клинического смысла.
Только в возрасте до 40 лет имеется статистически не значимая, но выраженная тенденция к большей эффективности такого сочетания в сравнении с применением одного тамоксифена, что может быть оправданием подавления функции яичников в этой возрастной группе. Выключение функции яичников является абсолютным условием проведения альтернативного варианта гормонотерапии больных репродуктивного периода, – гормонотерапии ингибиторами ароматазы.
Антиэстрогены. Среди лекарственных средств адъювантной гормонотерапии наиболее популярно применение тамоксифена.
Крупным пионерским исследованием по этой проблеме явилось рандомизированное сравнение 2-летнего приема тамоксифена (20 мг/сут) с отсутствием адъювантной системной терапии, проведенное группой NATO (Nolvadex Adjuvant Trial Organisation).
С 1977 по 1981 гг. в исследование было включено 1 285 больных. По сравнению с группой контроля лечение тамоксифеном при медиане прослеженности 66 мес.
снижало риск рецидива болезни на 36 и смерти на 29% (без учета уровней рецепторов эстрогенов (РЭ), репродуктивного статуса и поражения лимфатических узлов), достоверно повышалась БРВ и ОВ. Авторами было предложено изучение эффективности 5-летнего приема препарата [23]. Другие рандомизированные исследования, выполнявшиеся в те же годы, не смогли продемонстрировать столь очевидного успеха.
Более поздние публикации подтвердили высокую эффективность адъювантного применения тамоксифена. Большое количество рандомизированных исследований вошли в мета-анализ, проведенный Объединенной группой исследователей раннего рака молочной железы (Early Breast Cancer Trialists’ Collaborative Group) в 1992 г. В анализ было включено более 30 тыс.
рандомизированных больных, прослеженных не менее 10 лет. В целом применение тамоксифена снижало риск возврата болезни на 25, риск смерти — на 17% (относительные показатели).
При сравнении показателей выживаемости суммировались, с одной стороны, все группы больных, получавших тамоксифен и тамоксифен + химиотерапию, с другой стороны — все группы контроля с отсутствием лечения или проведением химиотерапии [11]. Гормонотерапия тамоксифеном проводилась без подавления функции яичников.
Относительное снижение риска рецидива болезни при приеме тамоксифена на протяжении 1 года составило 16%, в течение 2 лет — 27 и на протяжении 3-5 лет — 38%. Риск смерти снизился на 11, 18 и 24% соответственно.
При анализе, проведенном Early Breast Cancer Trialists’ Collaborative Group в 1998 г., у значительной части больных учитывался уровень РЭ в первичной опухоли. Риск рецидива снижался при приеме тамоксифена в течение 1 года на 20%, 2 лет – на 29, 5 лет – 47; снижение риска смерти составило 11, 17, и 26% соответственно. Детальнее результаты анализа представлены в табл. 1.
У больных с опухолями РЭ- (около 8 тыс.) улучшение от лечения не было очевидным.
В целом, вне зависимости от длительности приема тамоксифена снижение риска рецидива составило 10% (2р = 0,007), в том числе при лечении в течение 1, 2 и 5 лет – на 6% (статистически не достоверно), 13% (2р = 0,01), и 6% (статистически не достоверно) соответственно.
Достоверного влияния на ОВ не отмечено. Наблюдалось также снижение риска развития рака контралатеральной молочной железы при приеме тамоксифена в течение 1 года – на 13% (статистически не достоверно), 2 лет – на 26 (2p = 0,004), 5 лет – на 47% (2p
Источник: https://sportnoj.ru/lechenie-pervichno-operabelnogo-raka-molochnoj-zhelezy/
Неоадъювантная и адъювантная гормональная терапия рака предстательной железы | Experimental and clinical urology
Лечение рака предстательной железы (РПЖ) до настоящего времени остается сложной проблемой. В частности, это относится к вопросу: надо ли сочетать гормональную терапию с другими вариантами основного лечения? Принципиально, гормональную терапию, так же как и химиотерапию, можно сочетать с основным
методом лечения (неоадъювантный или адъювантный вариант). Сложность проблемы состоит в том, что гормональная терапия не является безразличной для организма.
При ее проведении меняется минеральная плотность костей, возрастает риск переломов (Daniell, 1997) (рисунок 1), развивается метаболический синдром, нарушения психики и т. д. Кроме того, сам по себе риск переломов значительно снижает продолжительность жизни больных (Oefelein et al.
, 2002). Таким образом, назначенная без показаний гормональная терапия является излишним и неоправданным методом лечения.
Рисунок 1. Андрогенная депривационная терапия увеличивает риск переломов
Неоадъювантная гормонотерапия РПЖ
В настоящее время существует 4 основных варианта неоадъювантной терапии рака предстательной железы.
- Неоадъювантная гормонотерапия (НеоГТ) + радикальная простатэктомия.
- Неоадъювантная химиотерапия(химиогормонотерапия) + радикальная простатэктомия.
- Неоадъювантная гормонотерапия + дистанционная лучевая терапия.
- Неоадъювантная гормонотерапия + брахитерапия и другие виды локального лечения.
Неоадъювантная гормонотерапия + радикальная простатэктомия
Вопрос о необходимости проведения гормонотерапии перед операцией остается дискутабельным. Существует теоретическое обоснование предоперационной гор-
монотерапии, включающее в себя следующее.
1. В 40-50% случаев клинически локализованного опухолевого процесса (Т1-Т2) при послеоперационном патоморфологическом исследовании выявляется экстракапсулярная инвазия (рТ3) (Zincke et al., 1994). 2. В эксперименте на животных (гормоно-чувствительная опухоль Shionogi) неоадъювантная гормонотерапия приводит к 50% снижению местных рецидивов и смертности от рака (Gleave et al., 1996).
Первым ученым, предложившим комбинированную или максимальную андрогенную блокаду, был Labrie (1993).
Основным недостатком хирургического лечения, является наличие так называемого положительного края, то есть, выявление опухоли по линии резекции, что может в дальнейшем неблагоприятно сказаться на течении заболевания.
В целом, по результатам исследований, проведенных на сегодняшний день, при назначении гормональной терапии перед операцией отмечаются: уменьшение объема опу- холи, значительное снижение ПСА, уменьшение осложнений, «измене-
ние» морфологической стадии до 77,2% (Labrie et al., 1993) (таблица 1).
Таблица 1. Неоадъювантная гормонотерапия (НеоГТ) (Labrie et al., 1993)
| Опухоль по линии резекции (%) | 13,0 | 38,5 |
| «Изменение» стадии (%) | рТ3 рТ2 – 23,4 | рТ2 рТ3 – 53,8 |
Преимущество НеоГТ в «изменении стадии» – 77,2%
(Labrie et al. 1993)
Однако существуют и некоторые особенности. Так, по данным Witjes et al. (1997), в группе больных с клинической стадией Т2 различия в частоте выявления опухоли по линии резекции оказались статистически достоверны в пользу НеоГТ, в группе больных с опухолями Т3 – различия недостоверны (таблица 2). Goldenberg et al. (1996), не отмечают различий в частоте осложнений
операции в группах пациентов, не получающих НеоГТ перед РПЭ, и пациентов, получивших данную терапию.
Таблица 2. Неоадъювантная гормонотерапия (НеоГТ) (Witjes et al., 1997)
| «Повышение» стадии (%) | 31 | 54 | < 0,01 |
| «Понижение» стадии (%) | 16 | 6 | < 0,01 |
| Опухоль по линии резекции (%) | 27 | 46 | < 0,01 |
В группе больных с клинической стадией Т2 различия в частоте выявления опухоли по линии резекции оказались статистически достоверны в пользу НеоГТ, в группе больных с опухолями Т3 – различия недостоверны
По данным Klotz (2003), биохимическое прогрессирование процесса наблюдалось у 33,6% в группе РПЭ и 37,5% – в группе НеоГТ при среднем периоде наблюдения за пациентами 6 лет. Безрецидивная выживаемость была одинаковой в обеих группах (р = 0,732).
В подгруппе больных с исходным уровнем ПСА > 20 нг/мл отмечено существенное улучшение безрецидивной выживаемости при проведении НеоГТ.
В нерандомизированном ретроспективном анализе наблюдений не отмечено улучшения результатов при пятилетнем наблюдении по биохимическому и клиническому рецидивированию.
Meyer F. et al. (2001), показали, что у 756 больных, получавших гормональную терапию более 3 месяцев, отмечено повышение безрецидивной выживаемости по сравнению с контрольной группой.
Hack М. и соавт. (2008), продемонстрировали, что НеоГТ в течение 6 месяцев при местно-распространенном, первично нерезектабельном (> сТ3) раке с высокими ха-
рактеристиками риска (Глисон > 8) или ПСА (> 20 нг/мл), увеличивала шансы для выживания без существенного риска пери- или постоперационных осложнений.
Таким образом, можно сделать следующие выводы:
- НеоГТ приводит к уменьшению объема опухоли на 30-50%;
- НеоГТ приводит к снижению уровня ПСА на 40-90% (чаще наблюдается у больных с клинической стадиуй Т2);
- НеоГТ не приводит к увеличению числа осложнений РПЭ;
- НеоГТ приводит к «снижению» патоморфологической стадии в 30%;
- НеоГТ приводит к уменьшению числа выявления опухолевого роста по линии резекции в 18-37% (статистически достоверно только для клинической стадии Т2).
Ни в одном из исследований не выявлено статистически достоверных различий в безрецидивной выживаемости и длительности периода до развития прогрессирования у больных, которым проводили НеоГТ и у больных, которым сразу выполняли оперативное вмешательство.
НеоГТ не может в настоящее время считаться стандартным методом лечения локализованного и местно-распространенного РПЖ.
Fair et al. (1995): «Хотя невозможно в настоящее время утверждать, что каждый больной получит пользу от проведения неоадъювантной гормональной терапии, нельзя также быть догматиком в утверждении, что это лечение абсолютно бес- полезно для больного».
Перспективным в изучении НеоГТ является назначение более длительного курса предоперационной гормонотерапии (возможно, до полного подавления уровня ПСА), более тщательный отбор больных (клиническая стадия Т2?, уровень
ПСА > 20 нг/мл?), поиск и применение новых схем гормонотерапии, химиотерапии, гормонохимиотерапии.
Неоадъювантная гормонотерапия перед дистанционной лучевой
терапией
Цель сочетанного применения лучевой терапии и гормонотерапии состоит в уменьшении объема опухоли и, соответственно, объема облучения, что приводит к снижению числа осложнений. При НеоГТ:
• 3-месячная неоадъювантная терапия агонистами ЛГРГ приводит к уменьшению объема предстательной железы на 37%;
• объем мочевого пузыря, на который приходится 95% дозы, уменьшается на 46%, объем прямой кишки – на 18% (Forman, 1995; Zelefsky, 1997).
• повышается эффективность лучевой терапии;
• снижается число клеточных клонов, которые должны быть уничтожены при лучевой терапии;
• индукция апоптоза увеличивается при сочетании гормонального и лучевого воздействия – переход клеток в S-фазу, что усиливает цитотоксическое действие облучения (Zietman, 1997; Pollak, 1997).
По данным Pilepich et al. в 2001, было выявлено, что комбинированная терапия (НеоГТ + лучевая) имеет ряд преимуществ перед монолучевой терапией.
Так, местные рецидивы при комбинированном лечении диагностированы в 30% случаев, а при лучевой терапии – в 42%.
Отдаленные метастазы выявлены соответственно у 34% и 45% больных. Безрецидивная выживаемость составила 33% при комбинированной терапии и 21% – при лучевой. Общая выживаемость в подгруппе больных с суммой Глисона 2-6 баллов была 70% и 52% соответственно. В то же время общая выживаемость и локо-
регионарный контроль в подгруппе больных с суммой Глисона 7 и более баллов достоверно не отличались.
А по данным Канадского многоцентрового исследования, проведенного Klotz et al. в 2000 г., при среднем периоде наблюдения 3 года отмечено существенное увеличение периода до биохимического прогрессирования в группе больных,
получавших НеоГТ ципротерона ацетатом (рисунок 2).
При среднем периоде наблюдения 3 года отмечено существенное увеличение периода до биохимического прогрессирования в группе больных, получавших НеоГТ ципротерона ацетатом
Рисунок 2. НеоГТ + лучевая терапия (Канадское многоцентровое исследование)
Следует отметить роль НеоГТ в уменьшении объема облучения. Результаты проведенных сравнительных исследований пациентов, находившихся на лечении в специализированных отделениях лучевой терапии в 2002-2003 гг. показали, что объем предстательной железы является прогностическим фактором токсичности при лучевой терапии локализованного РПЖ.
НеоГТ может уменьшить объем железы
(рисунок 3), а следовательно и планируемый объем облучения. При трансректальном УЗИ объем простаты до ГТ был 50,65″, а после лечения – 38,97″ (p < 0,001), что означает уменьшение объема железы на 24%.
Помимо предстательной железы, меньшая доза облучения приходится на зону семенных пузырьков, прямой кишки и мочевого пузыря.
Рисунок 3. Уменьшение объема ПЖ при НеоГТ
Таким образом:
- НеоГТ значительно уменьшает объем простаты, что может существенно снизить планируемый объем облучения, а следовательно и уровень V60 прямой кишки и мочевого пузыря;
- НеоГТ приводит к уменьшению объема предстательной железы и объема облучаемых тканей, что снижает токсичность лучевой терапии;
- НеоГТ приводит к увеличению времени до биохимического прогрессирования;
- •НеоГТ в комбинации с лучевой терапией не приводит к достоверному улучшению показателей общей и специфической выживаемости (улучшение выживаемости наблюдается только у больных с опухолями 2-6 баллов по шкале Глисона).
Адъювантная терапия
Адъювантная лучевая терапия после радикальной простатэктомии
Наиболее значимыми факторами развития биохимического рецидива после радикальной простатэктомии являются, по данным F. Pintoa, T. Prayer-Galettia, M. Gardimanb et al. (2006), уровень Gleason > 7 (p = 0,0003) и позитивный хирурги-
ческий край (p < 0,0001).
Кроме того, Han M., Partin A., Zahurak M. et al. еще в 2003 г. показали, что риск биохимического рецидива в группе пациентов с распространением опухоли за пределы капсулы (pT3) или при положительном крае резекции (R1) составляет 67% в течение 5 лет.
Несмотря на раннюю диагностику рака предстательной железы в рамках скрининга ПСА, около 50% пациентов после радикальной простатэктомии имеют как минимум один из вышеуказанных факторов риска (Karakiewicz P.I., Eastham J.A., Graefen. M. et al., 2005).
Существует два метода лечения пациентов, имеющих факторы риска после радикальной простатэктомии:
- адъювантная ЛТ – лучевая терапия на ложе предстательной железы непосредственно в послеоперационном периоде;
- активное наблюдение, включающее клиническое исследование и постоянное определение ПСА. Лучевая терапия и гормонотерапия остаются в резерве до момента биохимического и/или клинического рецидива (salvage- терапия).
До настоящего времени в клинических руководствах нет общепринятых показаний к применению адъювантной лучевой терапии при раке предстательной железы.
Однако вопросы обоснованности применения адъювантной ЛТ, показаний и противопоказаний к ее проведению в настоящее время являются предметом различных научных исследований.
Ниже перечислены только некоторые из рандомизированных проспективных исследований, посвященные данной проблеме:
- SWOG 8794, многоцентровое исследование Southwest Oncology Group (SWOG), набор пациентов с августа 1988 до января 1997;
- EORTC 22911 – многоцентровое исследование European Organisation for the Research and Treatment of Cancer (EORTC), набор пациентов с ноября 1992 до декабря 2001;
- ARO 96-02/AUO AP 09/95 –многоцентровое исследование Германского онкологического общества (German Cancer Society) набор пациентов с апреля 1997 по сентябрь 2004.
Проведенные исследования позволили определить показания и противопоказания к применению адъювантной лучевой терапии.
Обоснование применения адъювантной лучевой терапии
Адъювантная лучевая терапия является локальным вмешательством. Ее непосредственная задача – воздействие на резидуальные опухолевые клетки в ложе предстательной железы, чтобы свести к минимуму риск локального и биохимического рецидива.
При отсутствии лечения, резидуальные опухолевые клетки могут стать источником вторичной диссеминации и появления отдаленных метастазов, в результате чего задержка ЛТ до момента биохимического рецидива может уменьшить возможности лечения и ухудшить прогноз.
Конечной целью адъювантной ЛТ является улучшение показателей общей выживаемости, которое было продемонстрировано для других локализаций злокачественных новообразований.
Дополнительным преимуществом адъювантной по сравнению с отложенной ЛТ является отсутствие системной токсичности в результате гормонотерапии.
Противопоказания к применению адъювантной лучевой терапии
Основным аргументом против универсального применения АЛТ после простатэктомии в случае наличия факторов риска остается возможность «перелечивания» пациентов и использования ЛТ в случаях, когда необходимость в этом отсутствует.
Вторым аргументом является риск развития ранней и поздней токсичности со стороны органов малого таза, который сохраняется, несмотря на использование современных методик конформной лучевой терапии.
Решение проводить раннюю адъювантную лучевую терапию или отложить ее до развития рецидива представляет собой компромисс между стремлением продлить безрецидивный период и опасением развития поздних побочных эффектов, связан- ных с токсическим действием ЛТ.
Адъювантная гормонотерапия (агт)
Показания к адъювантной
гормонотерапии (АГТ) после РПЭ
- Метастазы в лимфатических узлах (N+).
- Инвазия семенных пузырьков.
- Локализованные и местно-распространенные опухоли.
Основная проблема – необходимо ли проводить немедленную АГТ или нужно начинать лечение при рецидиве?
По данным Prayer-Galetti et al. (2000), при наблюдении за больными в течение 5 лет, получено 25,2% преимущество в безрецидивной выживаемости для пациентов, получающих АГТ.
Адъювантная гормональная терапия после дистанционной лучевой терапии
По данным Pilepich et al. (2005), итогам 10-летних исследований стали следующие результаты.
- Общая выживаемость при лучевой терапии составила 39%, при комбинированном лечении – 49%.
- Смертность от РПЖ при лучевой терапии составила 22%, при комбинированном лечении – 16%.
Таким образом:
- АГТ после лучевой терапии достоверно улучшает безрецидивную выживаемость;
- АГТ после лучевой терапии (рисунок 4) достоверно улучшает общую выживаемость у больных с плохим прогнозом (опухоли Т3-4, дифференцировка 8-10 баллов по Глисону).
отношение рисков 0.50; 95% ДИ 0,33, 0,76; p = 0,001 Bolla et al. 1997, 1999
Рисунок 4. Лучевая терапия + АГТ (EORTC 22863)
Остается неясным вопрос: не является ли преимущество в выживаемости результатом применения гормонотерапии в большей степени, чем лучевой терапии?
Для ответа на этот вопрос Bolla M. et al. в 2007 г. выполнили протокол, в котором одна группа больных получала АГТ полгода, а другая три года. Причем авторы заранее были уверены, что результаты будут одинаковы.
Однако оказалось, что практически по всем показателям результаты у больных, которые получали гормональную терапию в течение трех лет, оказались лучше, чем у больных, которые получали ее в течение шести месяцев.
Таким образом, сегодня очевидно, что адъювантная гормональная терапия после лучевой терапии, особенно у больных с плохим прогнозом, должна проводиться в течение длительного времени, что обеспечивает более стойкие результаты.
Ключевые слова: рак предстательной железы, неоадъювантная гормонотерапия, адъювантная гормонотерапия, адъювантная лучевая терапия, радикальная простатэктомия.
Keywords: prostate cancer, neoadjuvant hormone therapy, adjuvant hormone therapy, adjuvant radiation therapy, prostatectomy.
| Скачать статью | 1.54 Мб |
Источник: http://ecuro.ru/article/neoadyuvantnaya-i-adyuvantnaya-gormonalnaya-terapiya-raka-predstatelnoi-zhelezy